1)Дайте определение понятиям :раствор, растворитель, растворенное вещество. Современная классификация плазмозаменяющих растворов в медицине.
В растворах протекает большее количество химических реакций организма. Раствор – это идеальная транспортная система, которая доставляет необходимые лекарственные средства непосредственно во внутреннюю среду организма. Также растворённые препараты лучше усваиваются организмом.
Раствор — это гомогенная система переменного состава, состоящая из двух и более независимых компонентов и продуктов их взаимодействия.
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. При одинаковых агрегатных состояниях компонентов растворителем считают то вещество, содержание которого в растворе больше.
Растворенное
вещество-компонент,
молекулы или ионы которого равномерно
распределены в объеме растворителя.
Плазмозаменяющие растворы( классификация):
1)Гемодинамические( противошоковые) растворы — предназначены для лечения шока различного происхождения и восстановления гемодинамики, в том числе микроциркуляции, при использовании аппаратов искусственного кровообращения для разведения крови во время операции. Например растворы глюкозы (полиглюкин), 8% -ный раствор расщеаленного пищевого желатина — препарат желатиноль и др.
2)Дезинотоксикационные растворы, применяемые при интоксикации различной этилогии. К лекарственным средствам этой группы относятся такие препараты, как гемодез, неогемодез, глюконеодез и др. Помимо поливинилпирролидона в состав растворов входят ионы магния, калия, кальция, натрия и хлора.
3)Регуляторы водно-солевого баланса и кислотно-основного состояния: солевые растворы (растворы электролитов), осмотические диуретики (глицерол, маннитол и мочевина)
4)Растворы
для парентерального питания,
которые служат для обеспечения
энергетических ресурсов организмв,
доставки питательных веществ к органам
и тканям.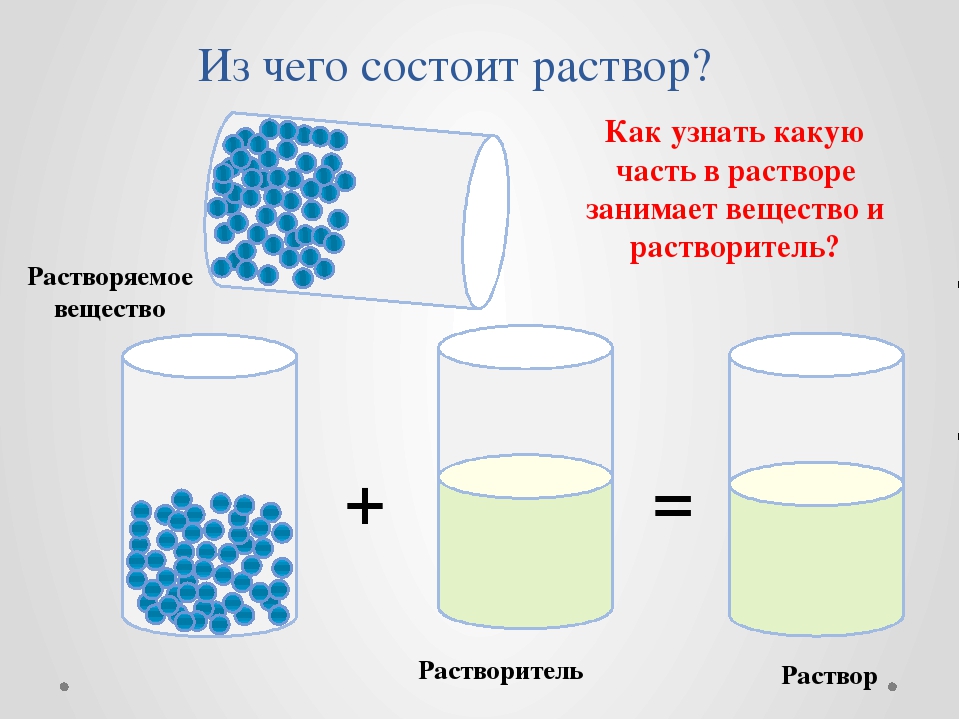 Например, растворы аминокислот,
жировые эмульсии, поливитаминные
комплексы и микроэлементы; комбинированные
препараты.
Например, растворы аминокислот,
жировые эмульсии, поливитаминные
комплексы и микроэлементы; комбинированные
препараты.
5)Переносчики кислорода, восстанавливающие дыхательную функцию крови( растворы модифицированного гемоглобина человека; эмульсии порфторуглеродов (ПФУ) например, перфторан)
6)Комплексные ( полифункциональные) растворы, обладающие широким диапазоном действия, которые могут состоять из нескольки групп плазмозаменяющих растворов.
2)Дайте определения, поясните физический смысл следующих способов выражения концентраций веществ в растворе: массовая доля, молярная концентрация, титр.
Массовая
доля
растворенного вещества w(Х)- величина
равная отношению массы растворенного
вещества m(Х) к массе раствора.
Массовая
доля вещества в растворе величина
безразмерная, она показывает , сколько
граммов растворенного вещества содержится
в 100 г раствора. Используется для
характеристики лекарственных препаратов,
физиологических растворов.
Молярная концентрация вещества в растворе с(Х)- величина, равная отношению количества растворенного вещества к объему раствора. Молярная концентрация вещества в растворе показывает, какое количество растворенного вещества содержится в 1 л раствора. Основная единица измерения в СИ — моль/м3, на практике-моль/л. Применяется для выражения концентрации различных веществ в биологических жидкостях.
Титр растворенного вещества T(X)- это масса растворенного вещества Х, содержащаяся в 1 мл раствора. Измеряется в г/см3, допускается записать г/мл. Это способ используется в микробиологии, общей гигиене, иммунологии.
3)
Молярная
концентрация эквивалента вещества Х, с(1X) –величина, равная отношению
количества вещества эквивалента n(z1X) в
растворе к объему этого раствора. Запись
«0,1 н. h3SO4» означает, что молярная
концентрация эквивалента вещества
h3SO4 равна 0,1 моль/л, т. е. в 1 л раствора
содержится 0,1 моль эквивалента вещества
h3SO4.
е. в 1 л раствора
содержится 0,1 моль эквивалента вещества
h3SO4.
Моляльная концентрация вещества Х в растворе, сm(Х) – это величина, равная отношению количества вещества к массе растворителя. Запись «сm(h3SO4) = 0,15 моль/кг» означает, что в 1 кг раствори- теля содержится 0,15 моль вещества h3SO4.
Молярная доля растворенного вещества N(X) – величина, равная отношению количества вещества данного компонента к сум марному количеству всех компонентов, входящих в состав раствора, включая растворитель n(A).
Эквивалент- реальная или условная частица вещества Х, которая в данной кислотно-основной реакции может присоединять, отдавать или быть каким-либо другим образом эквивалентна одному иону водорода или одному электрону в данной ОВР.
Фактор
эквивалентности f
4)Укажите основные способы приготовления растворов. Дайте краткую характеристику этим способам.
Существует 3 способа приготовления растворов заданных концентраций: 1.Из навески твердого вещества 2.Разбавлением более концентрированного раствора. 3.Из фиксанала.
Приготовление
раствора из навески тв. вещества.
Приготовление
раствора из фиксанала. 1.Выбрать
мерную колбу в соответствии с требуемым
объемом приготовляемого раствора.
2.Обмыть
ампулу фиксанала и разбить бойком над
воронкой в колбе.
3. Перенести содержимое
ампулы через воронку в выбранную мерную
колбу.
4.Промыть ампулу через воронку
в колбу.
5.Добавить воду в колбу до
метки и перемешать.
Перенести содержимое
ампулы через воронку в выбранную мерную
колбу.
4.Промыть ампулу через воронку
в колбу.
5.Добавить воду в колбу до
метки и перемешать.
Приготовление раствора разбавлением конц. раствора. 1.Определить плотность исходного концентрированного раствора с помощью ареометра. 2.Сделать расчет объема концентрированного раствора. 3.Отмерить необходимый объем концентрированного раствора цилиндра. 4.Перенести концентрированный раствор: а) в мерную колбу нужного объема, б) в немерную химическую посуду для приготовления раствора с массовой долей вещества в раствора. 5. Добавить : а) воды в мерную колбу до метки, б) рассчитанный объем воды в соответствующую химическую посуду. 6.Раствор перемешать.
5)Что такое титриметрический анализ? Какое правило лежит в основе этого метода. Укажите его математическое выражение. Какие требования предъявляют к реакциям, лежащим в основе титриметрического анализа.
Титриметрический
анализ —
метод количественного анализа, основанный
на точном измерении объема раствора
реагента, израсходованного на эквивалентное
взаимодействие с определяемым веществом.
В основе анализа определяемого вещества титриаметрическим методом лежит проведение химической реакции и установление состояния эквивалентности между взаимодействующими веществами
Требования: 1. Вещества, вступающие в реакцию должны реагировать в строго определенных количественных соотношениях. 2.Реакции должны протекать быстро и количественно , т.е быть практически необратимыми. Константа равновесия должна быть большой. 3.Реакции должны по возможности протекать при комнатной температуре. 4.Точка эквивалентности должна фиксироваться резко и точно. 5. Титрование не должно сопровождаться побочными реакциями.
Закон эквивалентов: В химических реакциях число моль эквивалентов всех веществ, вступивших в реакцию и образовавшихся в ней, всегда равны между собой.
Математическое выражение: С(f экв A)*V(A) = С(f экв B)*V (B)
Растворители и растворение — Справочник химика 21
Слабым местом теории Ван-Лаара является допущение о равенстве размеров молекул растворителя и растворенного вещества. Мелвин-Хьюз разработал статистическую теорию бинарных растворов, которая с учетом различия в размерах молекул дает следующее уравнение для осмотического давления [c.34]
Мелвин-Хьюз разработал статистическую теорию бинарных растворов, которая с учетом различия в размерах молекул дает следующее уравнение для осмотического давления [c.34] В неидеальных растворах мерой взаимодействия в них молекул растворителя и растворенных частиц является активность, которую называют еще эффективной концентрацией. Для растворов неэлектролитов и электролитов активности можно рассчитывать по закону распределения, по понижению давления над растворами, по повышению температуры кипения или понижению температуры замерзания, по измерению электропроводности или электродвижущих сил раствора.
Экстракт, т. е. жидкость, полученную при экстрагировании и состоящую из растворителя и растворенного вещества, высушивают при помощи водоотнимающих средств (см. стр. 154), после чего растворитель отгоняют, собирая установку, описанную выше (см. стр. 129). [c.142]
Во многих случаях деление их на растворитель и растворенные вещества условно. Обычно компонент, находящийся в избытке по сравнению с другими, называют растворителем, остальные же компоненты—растворенными веществами. Так, можно иметь растворы спирта или серной кислоты в воде и растворы воды в спирте или в серной кислоте. Если одним из компонентов раствора является жидкость, а другими—газы или твердые вещества, то растворителем считают жидкость. [c.159]
Обычно компонент, находящийся в избытке по сравнению с другими, называют растворителем, остальные же компоненты—растворенными веществами. Так, можно иметь растворы спирта или серной кислоты в воде и растворы воды в спирте или в серной кислоте. Если одним из компонентов раствора является жидкость, а другими—газы или твердые вещества, то растворителем считают жидкость. [c.159]
Таким образом, в предельно разбавленном растворе коэффициенты активности растворителя и растворенных веществ равны единице, если стандартные состояния выбраны для раствори теля—по уравнению (VI, 26а), для растворенных веществ—по уравнению (VI, 27). [c.211]
Константы В и С отражают отклонение раствора от закона предельно разбавленных растворов (закона Вант-Гоффа), связанное со значительной величиной 2 и со специфическим взаимодействием между растворителем и растворенным веществом. [c.260]
Из данных первой и второй колонок табл. 1.1 следует, что имеет место большое различие в экстракционной способности растворителей при, казалось бы, малых структурных изменениях (сравните цис- и транс-1,2-дихлорэтилен, 1,1,2-трихлорэтан, 1,1,2,2-тетрахлорэтан и пентахлорэтан). Специфические взаимодействия между растворителем и растворенным веществом должны играть определенную роль даже в таких предположительно несольватирующих растворителях. С практической точки зрения еще более важно, что низкокипящие хлорированные углеводороды (хлороформ, дихлорметан и в меньшей сте- [c.24]
Специфические взаимодействия между растворителем и растворенным веществом должны играть определенную роль даже в таких предположительно несольватирующих растворителях. С практической точки зрения еще более важно, что низкокипящие хлорированные углеводороды (хлороформ, дихлорметан и в меньшей сте- [c.24]
Различные взаимодействия между растворителем и растворенным веществом, растворителем и мембраной, растворенным веществом и мембраной еще больше усложняют выбор полимера. Если взаимодействие между растворенным веществом и мембраной сильное, а взаимодействие между растворителем и растворенным веществом слабое, может произойти избирательная адсорбция растворенного вещества мембраной, ведущая к ее закупориванию или набуханию. В любом случае проницаемость мембраны и ее селективность по мере адсорбции могут быстро ухудшаться. [c.70]
Расчет процесса разделения разбавленных растворов спиртов [180]. На обратноосмотическое разделение с использованием ацетатцеллюлозных мембран влияют одновременно полярные и неполярные (гидрофобные) характеристики молекул растворителя и растворенного вешества [c.226]
На обратноосмотическое разделение с использованием ацетатцеллюлозных мембран влияют одновременно полярные и неполярные (гидрофобные) характеристики молекул растворителя и растворенного вешества [c.226]
Рассмотренные выше расчетные уравнения были выведены для систем газ—твердое тело или газ—жидкость с газом, очень слабо растворимым в жидкости. При этом принималось, что в газовой фазе растворитель и растворенное вещество находятся в молекулярной форме. Однако имеется очень важный класс газовых растворов, в которых и растворитель, и растворенное вещество в той или иной степени ионизированы. К ним относятся, например, растворы солей, окислов и гидратов окислов металлов в плотном надкритическом водяном паре, играющем очень важную роль в ряде геологических и технических процессов. [c.14]
Растворы состоят иэ растворителя и растворенного вещества (веществ). Эти понятия условны. Если одним из составляющих растворов веществ является жидкость, а другими газы или твердые вещества, то растворителем обычно считают жидкость. В других случаях растворителем считают тот компонент (составную часть), которого больше. [c.230]
В других случаях растворителем считают тот компонент (составную часть), которого больше. [c.230]
Растворитель и растворенные вещества. Эти понятия в известной степени условны. Какое вещество, например, считать растворителем в смеси, состоящей наполовину из воды и спирта Иногда за растворитель принимают то вещество, которое при охлаждении раствора кристаллизуется первым. Так, из водно-спиртового раствора сначала выделяется вода ее можно считать здесь растворителем. Но, например, из многих водно-солевых растворов кристаллизуется сначала соль, а иногда одновременно и соль и лед. Можно принять за растворитель и то вещество, которое находится в преобладающем количестве, но при этом надо иметь в виду, что нередко оно при охлаждении раствора отвердевает не первым. Если одним из составляющих раствор веществ является жидкость, а другими — газы или твердые вещества, то растворителем обычно считают жидкость. [c.131]
Когда оба компонента (и растворитель, и растворенное вещество) близки между собой по составу и строению молекул, то сила взаимного притяжения молекул обоих компонентов примерно одинакова. В таких простейших системах давление насыщенного пара р данного компонента А над раствором прямо пропорционально относительному содержанию его молекул в растворе, т. е. [c.298]
В таких простейших системах давление насыщенного пара р данного компонента А над раствором прямо пропорционально относительному содержанию его молекул в растворе, т. е. [c.298]
Второй эффект, принятый во внимание Уэббом, связан с явлением электрострикции, т, е, сжатия, наблюдаемого при растворении, В результате электрострикции объем раствора становится меньше, чем сумма объемов чистого растворителя и растворенного вещества. На процесс сжатия расходуется некоторое количество энергии. Учет обоих эффектов приводит к тому, что величины энергий и теплот гидратации, вычисленные по формуле Борна — Уэбба, уменьшаются и приближаются к опытным, В теории Уэбба растворитель по-прежнему рассматривается ка ч непрерывная среда и не учитывается ни строение его молекул, пн структура жидкости. [c.56]
Установлено, что при экстракции неполярными экстрагентами при гемпературах вблизи критического состояния растворителей также проявляется избирательная растворимость высокомолекулярных углеводородов масляных фракций. Обусловливается это тем, что с приближением температуры экстракции к критической про — исхо, ит резкое снижение плотности растворителя и соответственное ослабление прочности связей между молекулами растворителя и растворенных в нем углеводородов. В то же время силы дисперсионного взаимодействия между молекулами самих углеводородов при этом практически не изменяются. В результате, при определен — 1ГЫХ гемпературах внутримолекулярные силы углеводородов могут превысить межмолекулярные силы взаимодействия между растворителем и углеводородами и последние выделяются в виде дисперсной фазы. При этом, поскольку энергия дисперсионного взаимодействия является функцией от молекулярной массы молекулы, в первую очередь из раствора выделяются наиболее высокомолекулярные смолисто-асфальтеновые соединения, затем по мере повышения температуры — углеводороды с меньптей молекулярной массой. При температурах, превышающих критическую,из раствора выделяются все растворенные в нем соединения независимо от молекулярной массы и химической структуры углеводородов (рис.
Обусловливается это тем, что с приближением температуры экстракции к критической про — исхо, ит резкое снижение плотности растворителя и соответственное ослабление прочности связей между молекулами растворителя и растворенных в нем углеводородов. В то же время силы дисперсионного взаимодействия между молекулами самих углеводородов при этом практически не изменяются. В результате, при определен — 1ГЫХ гемпературах внутримолекулярные силы углеводородов могут превысить межмолекулярные силы взаимодействия между растворителем и углеводородами и последние выделяются в виде дисперсной фазы. При этом, поскольку энергия дисперсионного взаимодействия является функцией от молекулярной массы молекулы, в первую очередь из раствора выделяются наиболее высокомолекулярные смолисто-асфальтеновые соединения, затем по мере повышения температуры — углеводороды с меньптей молекулярной массой. При температурах, превышающих критическую,из раствора выделяются все растворенные в нем соединения независимо от молекулярной массы и химической структуры углеводородов (рис.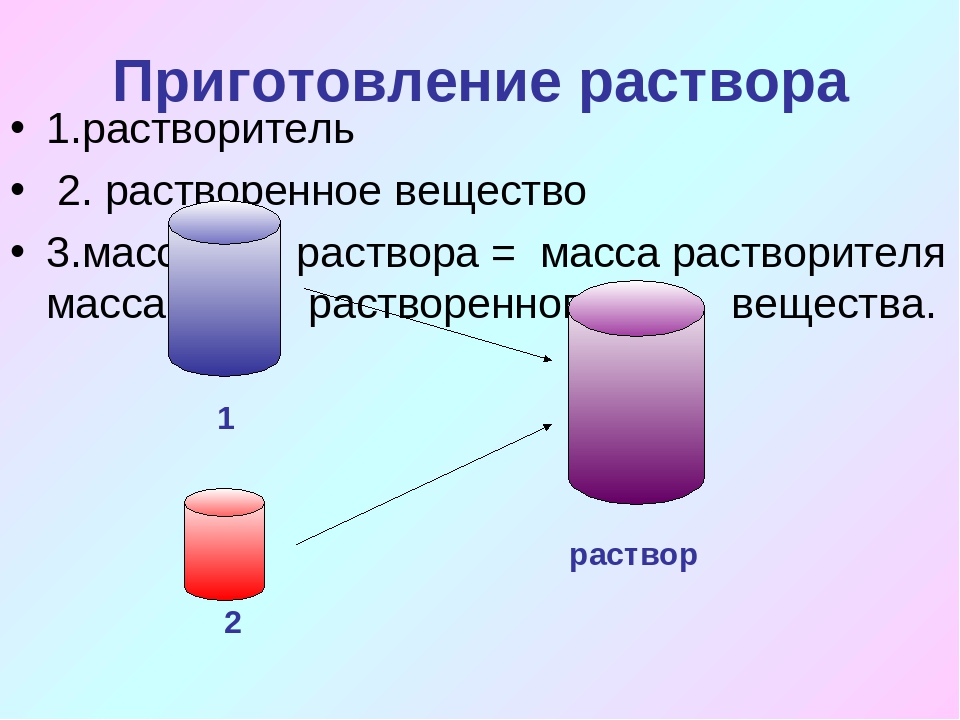 6.4). [c.221]
6.4). [c.221]
В этом случае взаимодействия внутри растворителя становятся величиной порядка ван-дер-ваальсовых сил, и, по всей вероятности, нельзя пренебрегать последними при рассмотрении взаимодействий диполь — растворитель и приписывать все изменение скорости диэлектрической проницаемости. Уравнение (XV.И.2) может применяться также для реакций между полярными молекулами в растворе [64]. Однако до сих пор не ясно, смогут ли эти уравнения быть использованы для изучения строения активированного комплекса или для дальнейшего развития теории растворов. (Автору кажется, что более детальная молекулярная модель раствора, учитывающая только взаимодействия между ближайшими соседними частицами, не так уж сложна, и она дала бы, вероятно, более интересные и полезные сведения. Параметрами в таком случае служили бы только дипольные моменты и радиусы молекул растворителя и растворенных частиц.) [c.458]
Отрицателькую адсорбцию можно истолковать только таким образом, что растворитель адсорбируется сильнее, чем растворенное вещество я при зтом повышается его молекулярная концентрация относительно исходного раствора. В системах неограниченно смешивающихся жидкостей, для которых можно рассматривать весь интервал концентраций, между растворителем и растворенным веществом отсутствует какое бы то ни было различие. По этой причине применение уравнения (2) к изотермам З-образного типа лишено смысла. [c.138]
В системах неограниченно смешивающихся жидкостей, для которых можно рассматривать весь интервал концентраций, между растворителем и растворенным веществом отсутствует какое бы то ни было различие. По этой причине применение уравнения (2) к изотермам З-образного типа лишено смысла. [c.138]
Прн растворении кристаллов происходит их разрушение, что требует затраты энергии. Поэтому растворение должно было бы сопровождаться поглощением теплоты. Если же наблюдается обратный эффект, то это показывает, что одновременно с растворением происходит кякое-то взаимодейстпие между растворителем и растворенным веществом, ири котором выделяется в виде теплоты больше энергии, чем се расходуется ип разруи]еиие кристаллической решетки. [c.216]
Растворители представляют собой однородные структурированные субстанции. При контакте между молекулами растворителя и растворенного вещества имеют место ион-дипольные взаимодействия. Степень сольватации указывает на количество таких взаимодействий. Взаимодействие тем больше, чем ближе контакт между растворимым веществом и растворителем. Дипольные, дисперсионные и индукционные взаимодействия, а также водородные связи действуют совместно с кулоновскими силами, и все вместе определяют стабильность и свойства ионных пар. Поэтому большое значение имеет природа» как растворенного вещества, так и растворителя. Сольватная оболочка уменьшает подвижность и коэффициенты диффузии как ионов, так и ионных пар. Способность апротонного растворителя к сольватированию не зависит от диэлектрической проницаемости, но в значительной степени определяется его элект-ронодонорными или электроноакцепторными свойствами. Рол [c.17]
Взаимодействие тем больше, чем ближе контакт между растворимым веществом и растворителем. Дипольные, дисперсионные и индукционные взаимодействия, а также водородные связи действуют совместно с кулоновскими силами, и все вместе определяют стабильность и свойства ионных пар. Поэтому большое значение имеет природа» как растворенного вещества, так и растворителя. Сольватная оболочка уменьшает подвижность и коэффициенты диффузии как ионов, так и ионных пар. Способность апротонного растворителя к сольватированию не зависит от диэлектрической проницаемости, но в значительной степени определяется его элект-ронодонорными или электроноакцепторными свойствами. Рол [c.17]
Полярные растворители растворяют полярные молекулярные вещества благодаря диполь-дипольному взаимодействию. Энергия, высвобождаемая при образовании диполь-дипольных связей между полярными молекулами растворителя и растворенного вещества, достаточна для разрыва межмолекулярных связей в молекулярных кристаллах (рис. 14-21). Например, лед растворим в жидком аммиаке, но не в бензоле потому, что Nh4-полярная молекула, а gHj-неполярная. [c.623]
14-21). Например, лед растворим в жидком аммиаке, но не в бензоле потому, что Nh4-полярная молекула, а gHj-неполярная. [c.623]
Полупроницаемые мембраны могут быть пористыми и непористыми. Непористые полимерные мембраны являются квазигомо-генными гелями, через которые растворитель и растворенные вещества проникают под действием градиента концентраций (молекулярная диффузия). Поэтому такие мембраны часто называют диффузионными. Скорость, с которой проходят через мембрану отдельные компоненты. [c.45]
При образовании раствора в общем случае происходит изменение свойств и растворителя, и растворенного вещества (растворенных веществ). Это обусловлено тем, что в растворе действуют силы, вызывающие и межмолекулярное взаимодействие (электростатическое, ван-дер-ваальсовы силы), ионно-дипольное взаимодействие, проявляющиеся на сравнительно значительных расстояниях, и специфическое взаимодействие (донорно-акцепторное, водородная связь), сказывающееся на сравнительно небольших расстояниях. Первое является общим для всех веществ оно связано с совокупностью физических процессов. Второе связано с перестройкой электронных оболочек молекул, атомов и ионов оно обусловлено химическими изменениями. [c.133]
Первое является общим для всех веществ оно связано с совокупностью физических процессов. Второе связано с перестройкой электронных оболочек молекул, атомов и ионов оно обусловлено химическими изменениями. [c.133]
ТО оба компонента склонны к образованию друг с другом сольватов или химических соединений разной степени прочности. В этом случае наблюдается повышенная растворимость вещества, а между растворителем и растворенным веществом часто образуются водородные или доиорно-ак-цепторные связи. Примером большой растворимости с образованием водородных связей является раствор этилового спирта в воде, а с образованием донорно-акцепторной связи — раствор аммиака в воде. Растворимость спирта не ограничена, а аммиак в воде растворяется в соотношении приблизительно 700 1 (по объему). [c.142]
Обменные реакции между растворителем и растворенным веществом, которые обычно протекают с образованием сла-бодиссоциирующих или труднорастворимых веществ, представляют особый интерес. Поэтому мы посвятим им отдельный раздел. Реакции взаимодействия между составными частями растворителя и растворенного вещества называются сольволиэом (для воды — гидролизом). [c.201]
Поэтому мы посвятим им отдельный раздел. Реакции взаимодействия между составными частями растворителя и растворенного вещества называются сольволиэом (для воды — гидролизом). [c.201]
В середине прошлого столетия при изучении явлений растворимости Грэм обратил внимание на то, что некоторые вещества, нерастворимые (в обычном смысле этого слова) в воде, могут все же в известных условиях образовывать виблне однородные по внешнему виду растворы. Такие растворы по многим свойствам обнаружили существенные отличия от обычных растворов. Так, в частности, растворенные вещества в этих растворах не проходя сквозь перепонки из некоторых естественных или искусственных материалов (растительный пергамент, пленки из целлофана, коллодия и др.), через которые легко проходят растворитель и растворенные вещества в обыкновенных растворах. В результате проведенных исследований этих явлений первоначально был сделан вывод, что вещества, которые проходят через подобные перепонки, обладают способностью кристаллизоваться из данного раствора, тогда как вещества, задерживающиеся ими, не способны кристаллизоваться. Первые вещества, по предложению Грэма, были названы кристаллоидами, а последние коллоидами — по названию клея (по-гречески — колла), как одного из представителей веществ этой группы. Первые образуют при растворении обычные, или, как их принято называть, истинные растворы, последние же образуют коллоидные растворы. [c.503]
Первые вещества, по предложению Грэма, были названы кристаллоидами, а последние коллоидами — по названию клея (по-гречески — колла), как одного из представителей веществ этой группы. Первые образуют при растворении обычные, или, как их принято называть, истинные растворы, последние же образуют коллоидные растворы. [c.503]
Лиофильными принято называть такие коллоиды, частицы которых в большом количестве связывают молекулы дисперсионной среды, например некоторые мыла в водной среде. Сюда относили раньше и растворы высокомолекулярных органических соединений (белки, целлюлоза и ее эфиры, каучук, многие искусственно получаемые соединения). Однако, как показало изучение внутреннего строения и свойств таких систем, производившееся в недавнее время, и, в частности, работы В. А. Каргина, Добри и Флори, эти системы представляют собой истинные растворы, т. е. молекулярно-дисперсные, а не коллоидные системы. Они являются гомогенными системами. Характерные отличия их свойств от свойств других групп истинных растворов обусловливаются в основном сильным различием в величине частиц растворителя и растворенного вещества и строением этих частиц, представляющих собой очень длинные и гибкие молекулы (цепное строение). Переход их в раствор облегчается высокой степенью сольватации. Благодаря большому размеру молекул растворы этих веществ по многим свойствам являются близкими коллоидным растворам и образуют самостоятельную группу растворов — растворы высокомолекулярных соединений. Более детально свойства этих растворов будут рассмотрены в гл. XVII ( 244). [c.508]
Переход их в раствор облегчается высокой степенью сольватации. Благодаря большому размеру молекул растворы этих веществ по многим свойствам являются близкими коллоидным растворам и образуют самостоятельную группу растворов — растворы высокомолекулярных соединений. Более детально свойства этих растворов будут рассмотрены в гл. XVII ( 244). [c.508]
Поскольку атомы растворителя и растворенного элемента твердого раствора имеют различ1п-)1е размеры, кристаллическая решетка твердого раствора замешения [c.124]
На практике наиболее часто приходится встречаты я с жидкими растворами. В жидком растворе обычно различают растворитель и растворенное вещество, хотя с термодинамической точки зрения все составляющие раствора равноценны. Под растворителем понимают то вещество, которое имеется в растворе в большем количестве. Остальные компоненты, присутствующие в растворе в меньших количествах, называются растворенными веществами. Такое деление на растворитель и растворенное вещество крайне условно, особенно если количества компонентов в растворе соизмеримы. Для образования жидкого раствора в качестве растворителя применяют воду или различные органические жидкости (спирты, кетоны, кислоты, эфиры, углеводороды). Нередко в качестве растворителей используют жидкий аммиак, серную кислоту и др. [c.339]
Для образования жидкого раствора в качестве растворителя применяют воду или различные органические жидкости (спирты, кетоны, кислоты, эфиры, углеводороды). Нередко в качестве растворителей используют жидкий аммиак, серную кислоту и др. [c.339]
Растворы газов в жидкостях можно рассматривать как системы, в которых устанавливается равновесие между жпдкой фазой, содер-жаш,ей растворитель и растворенный газ, и газовой фазой, содержащей данный газ и пары растворителя. Если растворитель относительно мало летуч, то равновесие можно представить как равновесие между раствором и практически чистым растворяемым газом. [c.381]
Если идеальный раствор состоит из двух летучих компонентов, то закон Рауля справедлив для растворителя и растворенного вещества Р, = Р -Х и Р, = Рз -х,- Общее давление пара над идеаяыгым раствором равно сумме парциальных давлений отдельных компонентов (закон Дальтона) [c.56]
R — улнверсальная постоянная, ис зависящая от природы растворителя и растворенного вещества и численно равная газовой постоянной (0,082 л атм/(моль-К)). [c.60]
[c.60]
Решение — Solution — qaz.wiki
Гомогенная смесь растворенного вещества и растворителя
Эта статья о химических растворах. Чтобы узнать о других значениях, см. Решение (значения) . «Solute» перенаправляется сюда. Для единственного отряда класса Homoiostelea см. Solute (иглокожие) . В химии , A раствор представляет собой особый тип гомогенной смеси состоит из двух или более веществ. В такой смеси растворенное вещество — это вещество, растворенное в другом веществе, известное как растворитель . Процесс смешивания раствора происходит в масштабе, в котором задействованы эффекты химической полярности , что приводит к взаимодействиям, специфичным для сольватации . Раствор обычно имеет состояние растворителя, когда растворитель составляет большую часть смеси, как это обычно бывает. Одним из важных параметров раствора является концентрация , которая является мерой количества растворенного вещества в данном количестве раствора или растворителя. Термин « водный раствор » используется, когда одним из растворителей является вода.
Термин « водный раствор » используется, когда одним из растворителей является вода.
Характеристики
- Раствор — это однородная смесь двух или более веществ.
- Частицы растворенного вещества в растворе нельзя увидеть невооруженным глазом.
- Раствор не позволяет пучки света к разбросу .
- Решение стабильное.
- Растворенное вещество из раствора нельзя отделить фильтрацией (или механически).
- Он состоит только из одной фазы .
Типы
Однородный означает, что компоненты смеси образуют единую фазу. Гетерогенность означает, что компоненты смеси имеют разную фазу. Свойства смеси (такие как концентрация, температура и плотность) могут быть равномерно распределены по объему, но только при отсутствии явлений диффузии или после их завершения. Обычно растворителем считается вещество, присутствующее в наибольшем количестве. Растворителями могут быть газы, жидкости или твердые вещества. Один или несколько компонентов, присутствующих в растворе, кроме растворителя, называются растворенными веществами. Раствор имеет то же физическое состояние, что и растворитель.
Один или несколько компонентов, присутствующих в растворе, кроме растворителя, называются растворенными веществами. Раствор имеет то же физическое состояние, что и растворитель.
Газовые смеси
Если растворителем является газ , то при заданном наборе условий растворяются только газы (неконденсирующиеся) или пары (конденсируемые). Примером газообразного раствора является воздух (кислород и другие газы, растворенные в азоте). Поскольку взаимодействия между газовыми молекулами почти не играют роли, неконденсирующиеся газы образуют довольно тривиальные решения. В литературе они даже не классифицируются как растворы, а просто рассматриваются как гомогенные смеси газов. Броуновское движение и постоянное молекулярное перемешивание молекул газа гарантируют однородность газовых систем. Смеси неконденсируемых газов ( например , воздух / CO 2 или воздух / ксенон) не расслаиваются самопроизвольно и не осаждаются, поскольку четко расслаиваются и разделяют слои газа в зависимости от их относительной плотности . Силы диффузии эффективно противодействуют силам гравитации при нормальных условиях, преобладающих на Земле. В случае конденсируемых паров дело обстоит иначе: как только достигается давление насыщенного пара при данной температуре, избыток пара конденсируется в жидкое состояние .
Силы диффузии эффективно противодействуют силам гравитации при нормальных условиях, преобладающих на Земле. В случае конденсируемых паров дело обстоит иначе: как только достигается давление насыщенного пара при данной температуре, избыток пара конденсируется в жидкое состояние .
Жидкие растворы
Если растворитель является жидкостью , могут быть растворены почти все газы, жидкости и твердые вещества. Вот некоторые примеры:
- Газ в жидкости:
- Кислород в воде
- Углекислый газ в воде — менее простой пример, потому что раствор сопровождается химической реакцией (образованием ионов). Видимые пузырьки в газированной воде — это не растворенный газ, а только бурление углекислого газа, вышедшего из раствора; сам растворенный газ не виден, поскольку он растворен на молекулярном уровне.
- Жидкость в жидкости:
- Смешивание двух или более веществ с одинаковым химическим составом, но с разными концентрациями с образованием константы.
 (Гомогенизация растворов)
(Гомогенизация растворов) - Алкогольные напитки — это в основном растворы этанола в воде.
- Смешивание двух или более веществ с одинаковым химическим составом, но с разными концентрациями с образованием константы.
- Твердое вещество в жидкости:
- Растворы в воде особенно распространены и называются водными растворами .
- Неводные растворы — это когда жидкий растворитель не является водой.
Противоположные примеры представлены жидкими смесями, которые не являются однородными : коллоиды , суспензии , эмульсии не считаются растворами.
Биологические жидкости являются примерами сложных жидких растворов, содержащих много растворенных веществ. Многие из них являются электролитами, поскольку содержат растворенные ионы, например калий . Кроме того, они содержат растворенные молекулы, такие как сахар и мочевина . Кислород и углекислый газ также являются важными компонентами химического состава крови , и значительные изменения их концентраций могут быть признаком серьезного заболевания или травмы.
Твердые решения
Если растворитель твердый , то могут быть растворены газы, жидкости и твердые вещества.
- Газ в твердых телах:
- Жидкость в твердом состоянии:
- Твердый в твердом:
Растворимость
Способность одного соединения растворяться в другом соединении называется растворимостью . Когда жидкость может полностью раствориться в другой жидкости, две жидкости смешиваются . Два вещества, которые никогда не могут смешаться с образованием раствора, считаются несмешивающимися .
Все растворы имеют положительную энтропию смешения. Взаимодействия между различными молекулами или ионами могут быть энергетически благоприятными или нет. Если взаимодействия неблагоприятны, то свободная энергия уменьшается с увеличением концентрации растворенного вещества. В какой-то момент потеря энергии перевешивает прирост энтропии, и растворенные частицы больше не могут растворяться; раствор называется насыщенным . Однако точка, в которой раствор может стать насыщенным, может значительно измениться в зависимости от различных факторов окружающей среды, таких как температура , давление и загрязнение. Для некоторых комбинаций растворенного вещества-растворителя перенасыщенный раствор может быть приготовлен путем повышения растворимости (например, путем увеличения температуры) для растворения большего количества растворенного вещества, а затем снижения ее (например, путем охлаждения).
Для некоторых комбинаций растворенного вещества-растворителя перенасыщенный раствор может быть приготовлен путем повышения растворимости (например, путем увеличения температуры) для растворения большего количества растворенного вещества, а затем снижения ее (например, путем охлаждения).
Обычно, чем выше температура растворителя, тем большее количество твердого вещества он может растворить. Однако растворимость большинства газов и некоторых соединений снижается с повышением температуры. Такое поведение является результатом экзотермической энтальпии раствора . Некоторые поверхностно-активные вещества демонстрируют такое поведение. Растворимость жидкостей в жидкостях обычно менее чувствительна к температуре, чем растворимость твердых тел или газов.
Характеристики
Физические свойства соединений , такие как температура плавления и температура кипения изменений при добавлении других соединений. Вместе они называются коллигативными свойствами . Есть несколько способов количественного определения количества одного соединения, растворенного в других соединениях, которые вместе называются концентрацией . Примеры включают молярность , объемную долю и мольную долю .
Есть несколько способов количественного определения количества одного соединения, растворенного в других соединениях, которые вместе называются концентрацией . Примеры включают молярность , объемную долю и мольную долю .
Свойства идеального решения можно вычислить путем линейной комбинации свойств его компонентов. Если растворенное вещество и растворитель существуют в равных количествах (например, в 50% этаноле , 50% водном растворе), понятия «растворенное вещество» и «растворитель» становятся менее актуальными, но вещество, которое чаще используется в качестве растворителя, обычно обозначается как растворитель (в данном примере вода).
Жидкость
В принципе, все типы жидкостей могут вести себя как растворители: жидкие благородные газы , расплавленные металлы, расплавленные соли, расплавленные ковалентные сети и молекулярные жидкости. В практике химии и биохимии большинство растворителей представляют собой молекулярные жидкости. Их можно разделить на полярные и неполярные , в зависимости от того, обладают ли их молекулы постоянным электрическим дипольным моментом . Другое различие заключается в том, могут ли их молекулы образовывать водородные связи ( протонные и апротонные растворители). Вода , наиболее часто используемый растворитель, является полярной и поддерживает водородные связи.
Их можно разделить на полярные и неполярные , в зависимости от того, обладают ли их молекулы постоянным электрическим дипольным моментом . Другое различие заключается в том, могут ли их молекулы образовывать водородные связи ( протонные и апротонные растворители). Вода , наиболее часто используемый растворитель, является полярной и поддерживает водородные связи.
Соли растворяются в полярных растворителях, образуя положительные и отрицательные ионы, которые притягиваются к отрицательному и положительному концам молекулы растворителя соответственно. Если растворителем является вода, гидратация происходит, когда заряженные ионы растворенного вещества окружаются молекулами воды. Стандартный пример — водный раствор соленой воды. Такие растворы называют электролитами . Всякий раз, когда соль растворяется в воде , необходимо учитывать ассоциацию ионов .
Полярные растворенные вещества растворяются в полярных растворителях, образуя полярные или водородные связи. В качестве примера, все алкогольные напитки водные растворы из этанола . С другой стороны, неполярные растворенные вещества лучше растворяются в неполярных растворителях. Примерами являются углеводороды, такие как масло и смазка, которые легко смешиваются, но несовместимы с водой.
Примером несмешиваемости нефти и воды является утечка нефти из поврежденного танкера, которая не растворяется в океанской воде, а плавает на поверхности.
Приготовление из составляющих ингредиентов
В лабораториях принято готовить раствор непосредственно из входящих в его состав ингредиентов. В практическом расчете есть три случая:
- Случай 1: указан объем растворителя.
- Случай 2: дано количество растворенного вещества.
- Случай 3: дан конечный объем раствора.
В следующих уравнениях A — растворитель, B — растворенное вещество и C — концентрация. Вклад объема растворенного вещества учитывается с помощью модели идеального раствора.
Вклад объема растворенного вещества учитывается с помощью модели идеального раствора.
- Случай 1: указан объем (мл) растворителя V A. Масса растворенного вещества m B = CV A d A / (100-C / d B )
- Случай 2: дано количество растворенного вещества m B. Объем растворителя V A = m B (100 / C-1 / d B )
- Случай 3: дано количество (мл) конечного объема раствора Vt. Масса растворенного вещества m B = C Vt / 100; Объем растворителя V A = (100 / C-1 / d B ) m B
- Случай 2: масса растворенного вещества известна, V A = m B 100 / C
- Случай 3: известен полный объем раствора, то же уравнение, что и в случае 1. V A = Vt; м B = CV A / 100
Пример: приготовьте 2 г / 100 мл раствора NaCl с 1 л воды. Вода (свойства) . Плотность полученного раствора считается равной плотности воды, что особенно важно для разбавленных растворов, поэтому информация о плотности не требуется.
Вода (свойства) . Плотность полученного раствора считается равной плотности воды, что особенно важно для разбавленных растворов, поэтому информация о плотности не требуется.
- m B = CV A = (2/100) г / мл × 1000 мл = 20 г
Смотрите также
Рекомендации
Растворитель и растворенное вещество — Энциклопедия по машиностроению XXL
Первый, идеальный , тип зависимости соответствует случаю когда /21=0. В этом случае коэффициенты активности растворителя и растворенного вещества равны единице во всем диапазоне концентраций, где справедливо соотношение (4.49). В этом случае G Q. Такие растворы называют идеальными. [c.93]Активности растворителя и растворенного вещества связаны друг с другом уравнением Гиббса—Дюгема [c.105]
Уменьшение давления пара над раствором по сравнению с чистым растворителем подтверждает принцип Ле Шателье.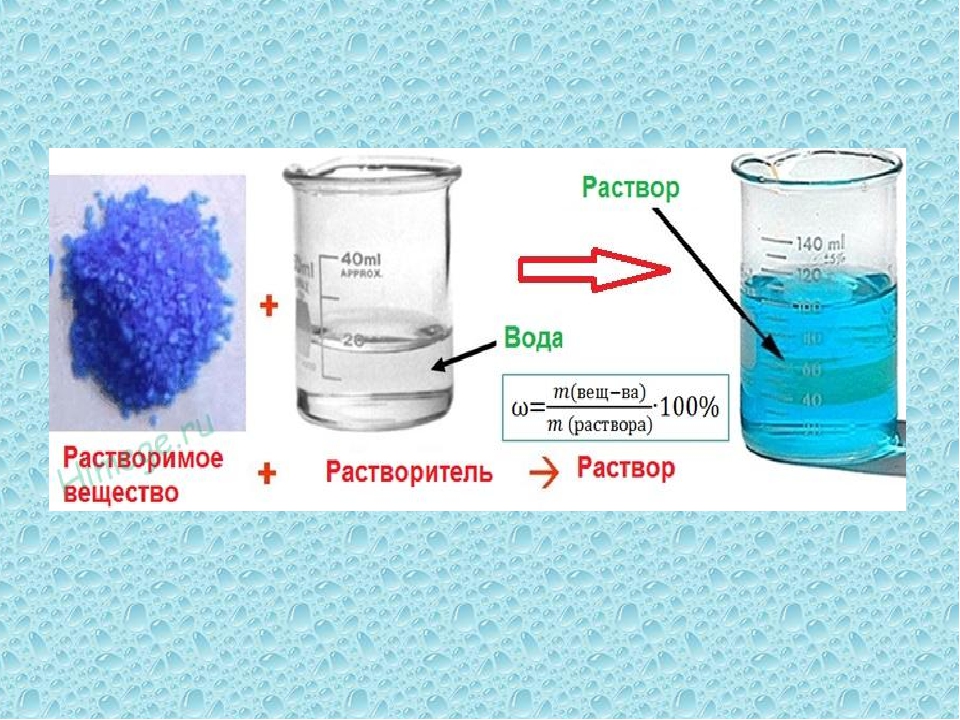 Так, например, при добавлении соли в систему вода — пар часть пара переходит в жидкость, его давление падает, а доля растворенного вещества уменьшается. Закон Рауля используется для экспериментального определения молярной массы различных веществ. Действительно, если и — соответственно массы растворителя и растворенного вещества (/Ла [c.226]
Так, например, при добавлении соли в систему вода — пар часть пара переходит в жидкость, его давление падает, а доля растворенного вещества уменьшается. Закон Рауля используется для экспериментального определения молярной массы различных веществ. Действительно, если и — соответственно массы растворителя и растворенного вещества (/Ла [c.226]
Пусть Ml и —молекулярные веса, и —навески растворителя и растворенного вещества. В этом случае = [c.215]
При контакте с растворителем и растворенным веществом ионит набухает. Причиной его набухания в растворах является наличие гидрофильных групп, причиной нерастворимости — наличие поперечных связей. Степень набухания зависит от ряда факторов, связанных со свойствами раствора и самого ионита. [c.24]
Растворитель и растворенное вещество 279 [c.279]
РАСТВОРИТЕЛЬ И РАСТВОРЕННОЕ ВЕЩЕСТВО
[c. 279]
279]
Сила электролита и коррозионная активность определяются его константой диссоциации /Сд, которая зависит Ьт энергии сродства-к протону растворителя и растворенного вещества и диэлектрической проницаемости растворителя D. Установлена линейная связь между /(д н D электролита в определенном растворителе и между кон- [c.335]
Наличие одинаковых химических свойств у растворителя и растворенного вещества [c.341]
Наличие одинаковых химических свойств у растворителя и растворенного вещества Хемосорбция молекул растворителя, препятствующая проникновению разряжающихся частиц к электроду [c.342]
Если поверхность адсорбента соприкасается с раствором, возможна адсорбция по крайней мере двух компонентов его — растворителя и растворенного вещества. Независимо от концентрации раствора, поверхность должна быть закрыта слоем адсорбата. По мере роста концентрации происходит, очевидно, вытеснение растворителя частицами растворенного вещества, молекулами или ионами его. Последний случай рассматривается в монографиях и курсах электрохимии [13, 12].
[c.74]
Последний случай рассматривается в монографиях и курсах электрохимии [13, 12].
[c.74]
Таким образом, оказывается, что наиболее благоприятными условиями получения квазилинейных спектров является примерное совпадение размеров молекул растворителя и растворенного вещества. При этом молекула закрепляется внутри кристаллической матрицы растворителя достаточно прочно, но не деформируется. При таком внедрении частоты колебаний не изменяются. [c.127]
Обозначим через и М2 соответственно молекулярный вес растворителя и растворенного вещества, а через р и р1 — плотность раствора и растворителя. Перечисленные величины связаны между собой определенными соотношениями [c.211]
Для некоторых типов высокополимерных растворов химические потенциалы растворителя и растворенного вещества приближенно выражаются следующим образом [c.247]
Данные по теплоемкостям широко используют также и при исследовании растворов. Во многих работах, посвященных изучению свойств растворов, делают попытки установить связь между термическими характеристиками, в частности теплоемкостью и другими свойствами, например структурой растворов [22, 23]. При изучении растворов теплоемкость нередко выражают в виде парциальных величин, т. е. рассматривают раздельно теплоемкости растворителя и растворенного вещества (см. гл. 15). В некоторых случаях при определенных допущениях, например допущении равенства парциальных теплоемкостей гидратированных ионов К+ и С1 , имеющих примерно одинаковые размеры, переходят к парциальным теплоемкостям отдельных ионов в растворе [23].
[c.248]
Во многих работах, посвященных изучению свойств растворов, делают попытки установить связь между термическими характеристиками, в частности теплоемкостью и другими свойствами, например структурой растворов [22, 23]. При изучении растворов теплоемкость нередко выражают в виде парциальных величин, т. е. рассматривают раздельно теплоемкости растворителя и растворенного вещества (см. гл. 15). В некоторых случаях при определенных допущениях, например допущении равенства парциальных теплоемкостей гидратированных ионов К+ и С1 , имеющих примерно одинаковые размеры, переходят к парциальным теплоемкостям отдельных ионов в растворе [23].
[c.248]
Наиболее полно характеризует интегральную концентрацию всех составляющих минеральных примесей электропроводимость Н-катионированной пробы, определяемая кондуктометрами АК-310 и АКК-1. Электропроводимость растворов зависит от физико-химических свойств растворителя и растворенного вещества концентрации и подвижности ионов, температуры и вязкости растворителя и других факторов.
 Электропроводимость раствора, находящегося между параллельными электродами на расстоянии 1 см и площадью 1 см , называется удельной электропроводимостью. Зависимость между удельной электропроводимостью раствора и его электрическим сопротивлением обратно пропорциональная
[c.235]
Электропроводимость раствора, находящегося между параллельными электродами на расстоянии 1 см и площадью 1 см , называется удельной электропроводимостью. Зависимость между удельной электропроводимостью раствора и его электрическим сопротивлением обратно пропорциональная
[c.235]Где находится граница, за которой применение упрощенного уравнения (У1-3) дает неверный результат Для разных веществ эта граница оказывается различной, зависящей от соотношения атомных масс растворителя и растворенного вещества. Чем ближе друг к другу значения атомных масс растворителя и растворенного вещества, тем дальше эта граница, тем для более широкого диапазона растворов может быть применима упрощенная формула. [c.198]
Однако такие условия могут быть только при выпарке однокомпонентных жидкостей, физические параметры которых не изменяются в процессе испарения. При выпарке растворов твердых веществ коэффициенты теплопередачи сильно зависят не только от физической природы растворителя и растворенного вещества, но и от концентрации выпариваемого раствора (понижаются с увеличением последней). [c.154]
[c.154]
Взаимодействие растворителя и растворенного вещества [c.50]
Такое различие возникает потому, что образование растворов обусловлено взаимодействием между элементарными частицами растворителя и растворенного вещества в газах это взаимодействие между элементарными частицами будет очень слабо выражено, ввиду малой плотности вещества, и в большинстве случаев им можно пренебречь (кроме состояний, близких к критическому). [c.223]
В реальном случае взаимодействие между молекулами растворителя и растворенного вещества влияет на поведение растворенного вещества в растворе. [c.264]
Что следует понимать под разбавленным и совершенным растворами Выразите химический потенциал для растворителя и растворенного вещества в этих растворах. [c.217]
Представим себе раствор под действием консервативной внешней силы, перемещающей в некотором направлении частицы растворенного вещества. И растворитель, и растворенное вещество оба будут обладать в поле этой силы некоторой потенциальной энергией эту энергию для одного моля растворителя обозначим через Р, а для одного моля растворенного вещества — через Рг. Допустим, для простоты, что Р и Рг зависят только от одной из координат, 2 , и рассмотрим столб раствора, ось которого совпадает с осью 2 , а поперечное сечение равно 1 см . Случай этот во многом походит на предыдущий. Выделим мысленно некоторый слой высоты ( 2. Сохранив за ж и г> их прежний смысл, найдем, что этот слой содержит (1 — молей первого и ж молей второго вещества. Пусть Ф — свободная энергия одного моля смеси (потенциальную энергию мы в Ф не включаем) тогда условием равновесия, в силу необходимости, чтобы свободная энергия всей системы была минимальной, служит уравнение
[c.125]
И растворитель, и растворенное вещество оба будут обладать в поле этой силы некоторой потенциальной энергией эту энергию для одного моля растворителя обозначим через Р, а для одного моля растворенного вещества — через Рг. Допустим, для простоты, что Р и Рг зависят только от одной из координат, 2 , и рассмотрим столб раствора, ось которого совпадает с осью 2 , а поперечное сечение равно 1 см . Случай этот во многом походит на предыдущий. Выделим мысленно некоторый слой высоты ( 2. Сохранив за ж и г> их прежний смысл, найдем, что этот слой содержит (1 — молей первого и ж молей второго вещества. Пусть Ф — свободная энергия одного моля смеси (потенциальную энергию мы в Ф не включаем) тогда условием равновесия, в силу необходимости, чтобы свободная энергия всей системы была минимальной, служит уравнение
[c.125]
Экспериментальные исследования ПО казывают, что при ПО строении теории бесконечно разбавленных растворов наиболее целесообразно исходить из закона Генри, так как в разбавленных растворах легче обнаружить отклонения от закона Генр и, чем отклонения от закона Рауля. Следует отметить также, что при формулировке зако номериостей, которым подчиняется давление пара разбавленных растворов, мы не использовал и явное выражение для химического потенциала растворителя и растворенных веществ в разбавленном растворе. Как будет показано в гл. 3, анализ уравнения Гиббса—Дюгема (1.32) и применение закона Генри (2.45) (в сочетании с некоторыми другими утверждениями нетермодинамического характера) позволяют найти аналитические выражения для химических потенциалов веществ в предельно разбавленных растворах.
[c.41]
Следует отметить также, что при формулировке зако номериостей, которым подчиняется давление пара разбавленных растворов, мы не использовал и явное выражение для химического потенциала растворителя и растворенных веществ в разбавленном растворе. Как будет показано в гл. 3, анализ уравнения Гиббса—Дюгема (1.32) и применение закона Генри (2.45) (в сочетании с некоторыми другими утверждениями нетермодинамического характера) позволяют найти аналитические выражения для химических потенциалов веществ в предельно разбавленных растворах.
[c.41]
Определение парциально-молярных объемов растворителя и растворенного вещества V и V2 производят следующим образом. Вначале определяют значения V для различных концентраций растворенного вещества, которым соответствуют значения р. Далее строят график зависимости V = /(A 2). Принимают приближенно, что между соседними точками V i(yVi) и УзСЛ з) зависимость линей- [c.247]
Электролитическая диссоциация заключается в расщеплении молекул солей металлов, находящихся в растворе, на положительные и отрицательные сольватированные ионы (рис. 3.46) в результате взаимодействия этих солей с растворителем. Необходимое условие явления — молекулы растворителя и растворенного вещества должны иметь полярное строение. Соли металла при этом образуют положительно заряженные ионы этого металла и отрицательные ионы кислотного остатка. Растворенный металл приобретает в результате этого процесса положительный электрический потенциал (равновесный потенциал). Таким образом, рас-твор-электролит содержит ионы осаждаемого материала. В состав растворов входит также кислота, которая при диссоциации образует положительно заряженные ионы водорода и ионы кислотного остатка. Молекулы воды также образуют ионы водорода и ионы гидроксильной группы. Однако ионы, образовавшиеся в результате электролитической диссоциации, движутся в растворе беспорядочно.
[c.407]
3.46) в результате взаимодействия этих солей с растворителем. Необходимое условие явления — молекулы растворителя и растворенного вещества должны иметь полярное строение. Соли металла при этом образуют положительно заряженные ионы этого металла и отрицательные ионы кислотного остатка. Растворенный металл приобретает в результате этого процесса положительный электрический потенциал (равновесный потенциал). Таким образом, рас-твор-электролит содержит ионы осаждаемого материала. В состав растворов входит также кислота, которая при диссоциации образует положительно заряженные ионы водорода и ионы кислотного остатка. Молекулы воды также образуют ионы водорода и ионы гидроксильной группы. Однако ионы, образовавшиеся в результате электролитической диссоциации, движутся в растворе беспорядочно.
[c.407]
Неограниченные твердые растворы с железом образуют Ni, Со, Мп, Сг и V Причем Ni, Со и Мп образуют непрерывные твердые растворы на основе у-железа, а Сг и V на основе а-железа Здесь соблюдается первое условие Юм-Розери —изоморфность решеток растворителя и растворенного вещества При разных типах решеток компонентов неограниченный твердый раствор образован быть не может Это условие является необходимым, но недостаточным для образования неограниченных твердых растворов, а именно, далеко не всегда изоморфность решеток приведет к созданию таких твердых растворов Это хорошо видно на примере систем а железо — Мо, а-железо — W (о ц к решетки), а также ужелезо —Си, у-железо—А1 (г ц к решетки) В этих системах образуются ограниченные твердые растворы, несмотря на однотипность решеток железа и легирующего элемента
[c. 34]
34]
Disordering — Разупорядочивание. Формирование кристаллической решетки твердого раствора, при котором атомы растворителя и растворенного вещества занимают произвольное положение. [c.939]
С целью установления степени активности добавок Nb, Zr и La в аустенитной стали автор работы [105] определил Да, АТцл и Д5 растворителя и растворенного вещества и показал, что наибольшей активностью обладает La, наименьшей — Nb. Эта работа является почти единственной, где сделана попытка привлечь критерии поверхностной активности для выбора модификатора к стали. Все же правомерность использования критерия Д пл вызывает сомнение. [c.115]
Среди ограниченных твердых растворов на основе элементов группы IB парциальные избыточные свободные энергии растворенного вещества в растворе при бесконечном разбавлении показывает почти линейную зависимость от разницы электроотрицательностей между растворителем и растворенным веществом [157]. Подобная связь показана для различных растворенных веществ в жидких растворителях, принадлежащих к группам элементов IB, ПВ, IIIB, IVВ и VB (рис. 9), вместе с этой связью проявл-яется монотонная зависимость при переходе от растворителей группы IB к растворителям группы VB. Полезность этой корреляционной связи ограничивается точностью термодинамических данных и данных по электроотрицательностям.
[c.62]
9), вместе с этой связью проявл-яется монотонная зависимость при переходе от растворителей группы IB к растворителям группы VB. Полезность этой корреляционной связи ограничивается точностью термодинамических данных и данных по электроотрицательностям.
[c.62]
Для выражения концентрации в терлмохимии обычно используется соотношение молей растворителя и растворенного вещества в растворе. [c.13]
Каких-либо строгих правил относительно того, какой фазе должно быть отдано предпочтение, нет ни для одного типа соединений. Однако в общем случае лучше всего получаются спектры чистых жидкостей или разбавленных растворов, хотя бывают веские причины практического и теоретического порядка, заставляющие выбирать и другие состояния вещества-При исследовании спектров разбавленных растворов в неполярных растворителях почти полностью исключаются межмолекуляр-ные взаимодействия растворенного вещества, хотя некоторые наиболее сильные из их могут все-таки оставаться (см. о водородных связях, стр. 63). Однако при этом иногда появляется ряд новых ограничений в связи с недостаточной растворимостью и поглощением самого растворителя. Кроме того, когда для повышения растворимости необходимо шользоваться полярными растворителями, следует учитывать, что в таких растворах воз-иикает сильное взаимодействие между молекулами растворителя и растворенного вещества. Ни один из растворителей не
[c.47]
о водородных связях, стр. 63). Однако при этом иногда появляется ряд новых ограничений в связи с недостаточной растворимостью и поглощением самого растворителя. Кроме того, когда для повышения растворимости необходимо шользоваться полярными растворителями, следует учитывать, что в таких растворах воз-иикает сильное взаимодействие между молекулами растворителя и растворенного вещества. Ни один из растворителей не
[c.47]
Молекулы растворителя могут ассоциироваться, ориентируясь или вокруг молекулы растворенного вещества в целом,, или вокруг одной какой-либо функциональной группы. Молекула хлороформа, содержащая атом водорода и атомы хлора, по-лярна, что повышает способности хлороформа как растворителя по сравнению с четыреххлористым углеродом, однако это происходит за счет увеличения ассоциации молекул растворителя и растворенного вещества. Ассоциация вызывает отдельные небольшие смещения полос поглощения по частоте, особенно полос валентных колебаний С=0, О — Н и N — Н, по сравнению со спектрами растворо-в в неполярных сероуглероде и четыреххлористом углероде, молекулы которых симметричны. Незначительные смещения указанных полос валентных колебаний наблюдаются также в случае растворов в бензоле и других растворителях, не содержащих полярного атома водорода. Ацетон,
[c.50]
Незначительные смещения указанных полос валентных колебаний наблюдаются также в случае растворов в бензоле и других растворителях, не содержащих полярного атома водорода. Ацетон,
[c.50]
В простейшем случае перегонка почти не отличается от вьшарки. Но выпарке подвергаются растворы, состоящие из летучего растворителя и практически нелетучего растворенного вещества, а при перегонке в пар переходят и растворитель и растворенное вещество. [c.99]
Диффузионные мембраны обычно применяют для разделения газов, жидких смесей методами испарения через мембрану, диализа. Диффузионные мембраны являются практически непористыми. Они представляют собой квазигомогенные гели, через которые растворитель и растворенные вещества проникают под действием градиента концентраций (молекулярная диффузия). [c.315]
Предложено несколько других корреляционных методов. Галушка и Колвер [86] рекомендуют уравнение, которое связывает О дз с составом, но требует знания Од , >вд, вязкостей растворенного вещества, растворителя и смеси, а также мольных объемов растворителя и растворенного вещества. При проверке на семи сильно неидеальных бинарных смесях их уравнение в пяти случаях коррелирует экспериментальные данные лучше, чем соотношение Вайнеса. Ратклиф и Холд-крофт [180] предположили, что для диффузии газов в электролитах может быть применен закон Генри с целью модификации коэффициента диффузии, поскольку вязкость раствора изменяется с концентрацией электролита.
[c.501]
При проверке на семи сильно неидеальных бинарных смесях их уравнение в пяти случаях коррелирует экспериментальные данные лучше, чем соотношение Вайнеса. Ратклиф и Холд-крофт [180] предположили, что для диффузии газов в электролитах может быть применен закон Генри с целью модификации коэффициента диффузии, поскольку вязкость раствора изменяется с концентрацией электролита.
[c.501]
При образовании твердого pa TBOipa сохраняется решетка одного из элементов и этот элемент называется растворителем. Атомы растворенного вещества искажают и изменяют средние размеры элементарной ячейки растворителя. [c.101]
Растворы
Авторы: Гаммель И. В., Кононова С. В., Раскаткина Л. В.I. РАСТВОРЫ. ОСНОВНЫЕ ПОНЯТИЯ.
Раствор – это твердая, жидкая или газообразная однородная система, состоящая из двух или более компонентов.
Раствор – это жидкая лекарственная форма, полученная путем растворения одного или нескольких лекарственных веществ и предназначенная для внутреннего, наружного или парентерального применения.
1.1. Классификация растворов.
1.1.1. По составу:
а) Простые растворы
б) Сложные растворы
4.1.2. По способу применения:
а) Для внутреннего применения (микстуры, капли)
б) Для наружного применения (капли, примочки, полоскания)
4.1.3. По физико-химической природе:
а) Гомогенные системы
— Истинные растворы
— Растворы высокомолекулярных соединений
б) Гетерогенные системы
— Коллоидные растворы
— Суспензии
— Эмульсии
1. 1.4. В зависимости от применяемых растворителей:
1.4. В зависимости от применяемых растворителей:
а) Водные растворы
б) Спиртовые растворы
в) Масляные растворы
г) Глицериновые растворы
д) Растворы на синтетических растворителях
Преимущества растворов:
1) Высокая биодоступность
2) Широкий спектр назначения
3) Простота приготовления
4) Удобство применения
5) Возможность корригировать вкус, цвет, запах лекарственных веществ.
Недостатки растворов:
1) Неудобство транспортировки (некомпактность упаковки)
2) Возможность микробного загрязнения
3) Вероятность гидролиза лекарственных веществ
Растворители для жидких лекарственных форм – это индивидуальные химические соединения или их смеси, способные растворять различные вещества и образовывать с ними однородные смеси – растворы, состоящие из одного или нескольких компонентов.
Классификация растворителей:
1) Неорганические (вода очищенная)
2) Органические
— Летучие
1. Этиловый спирт
2. Эфир медицинский
3. Хлороформ
— Нелетучие
1. Глицерин
2. Масла растительные
3. Масло вазелиновое
4. Диметилсульфоксид (димексид)
Требования к растворителям:
1. Достаточная растворяющая способность
2. Химическая и фармакологическая индифферентность
3. Безопасность в пожарном отношении
4. Рациональность с точки зрения биофармации
5. Должны быть экономически выгодны и доступны.
1.3. Истинные растворы.
Истинные растворы – это однородные системы, молекулярной или ионной степени дисперсности, то есть лекарственные вещества в ней диспергированы до ионно-молекулярного состояния.
В молекулярно-дисперсных системах размер частиц порядка 0,1 нм. К ним относят: растворы неэлектролитов (сахар, спирт). Растворенное вещество распадается на отдельные кинетические самостоятельные молекулы.
В ионно-дисперсных системах размер частиц порядка 0,1 нм. К ним относят растворы электролитов (натрия хлорид, магния сульфат). Растворенное вещество находится в виде отдельных гидратированных ионов и молекул в некоторых равновесных количествах. Истинные растворы являются однофазными системами, они гомогенны даже при рассматривании в электронный микроскоп и их компоненты не могут быть разделены фильтрованием или каким-либо другим способом.
Лекарственные вещества обладают разной способностью к растворению в воде и других растворителях. Растворимость данного лекарственного вещества в воде (и в другом растворителе) зависит от температуры. Для подавляющего большинства твердых веществ растворимость увеличивается с повышением температуры. Некоторые лекарственные вещества растворяются медленно, с целью ускорения растворения прибегают к нагреванию, предварительному измельчению лекарственного вещества и перемешиванию смеси.
1.4. Концентрация.
Концентрация – это количество вещества, растворенного в определенном количестве растворителя.
В зависимости от метода изготовления раствора содержание лекарственных веществ в жидких лекарственных формах выражают различными способами в соответствии с приказом МЗ РФ № 308 от 21.10.1997.
1) Массо-объемная концентрация – это количество лекарственного вещества (в граммах) в общем объеме лекарственной формы (в мл),
2) Концентрация по массе – это количество лекарственного вещества (в граммах) в общей массе лекарственной формы (в граммах),
3) Объемная концентрация – это количество жидкого лекарственного вещества (в мл) в общем объеме лекарственной формы (в мл).
Способы обозначения концентрации.
В прописях рецептов концентрация может быть обозначена:
1) В процентах (%).
2) Раздельным перечислением лекарственного вещества и дисперсионной среды (растворителя).
3) С указанием растворителя до заданного объема или массы (ad).
4) С указанием соотношения массы или объема растворяемого лекарственного вещества и объема или массы раствора.
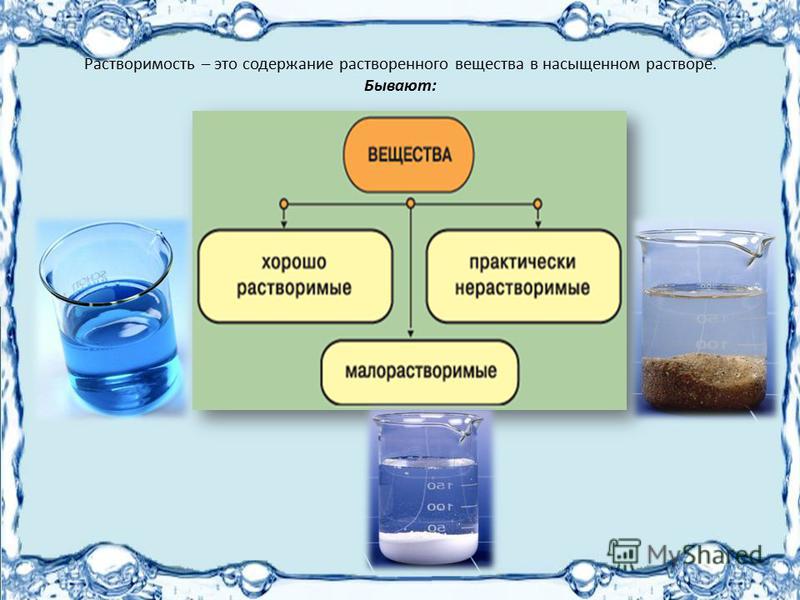
1.5. Растворимость.
Растворимостью называют свойство вещества растворяться в воде или других растворителях. В фармацевтической практике растворимость обозначается в виде отношения количества растворенного вещества к количеству насыщенного раствора, которое нужно из него приготовить. В фармацевтической практике используются таблицы растворимости в виде отношения одной массовой части вещества к необходимому количеству растворителя. Сведения о растворимости лекарственных веществ находятся в частных статьях ГФ.
Насыщенный раствор – это раствор, в котором скорость растворения лекарственного вещества и скорость оседания частиц равны.
Факторы, влияющие на растворимость:
1. Природа лекарственного вещества и растворителя
2. Сила связи между молекулами или ионами растворяемого вещества
3. Сила диффузии
4. Сила взаимодействия между веществом и растворителем
5. Температура
6. Степень дисперсности.
Чтобы читать дальше, купите книгу.
Стоимость:
Разница между растворенным веществом и растворителем
Раствор и растворитель являются частью раствора, где растворенное вещество в любом растворе или смеси называется растворенным веществом, а жидкость или газ, который растворяет другую жидкость, твердое вещество или газ, называется растворителем .
Раствор может быть определен как гомогенная смесь двух или более веществ. Таким образом, в растворе вещество, которое растворяется, является растворенным, тогда как растворитель является веществом, в котором растворяется растворенное вещество. В повседневной жизни существует множество продуктов, приготовленных из смеси одного или нескольких растворенных веществ и растворителей и образующих раствор. К таким продуктам относятся лекарства, мыло, мази, чай, кофе, сок лайма и т. Д.
В повседневной жизни существует множество продуктов, приготовленных из смеси одного или нескольких растворенных веществ и растворителей и образующих раствор. К таким продуктам относятся лекарства, мыло, мази, чай, кофе, сок лайма и т. Д.
Гомогенная смесь — это раствор, в котором растворенные вещества полностью и равномерно растворяются в растворе. При этом растворимость — это способность вещества растворяться в другом веществе. В этой статье мы обсудим разницу и характеристики растворенного вещества и растворителя.
Сравнительная таблица
| Основа для сравнения | растворенное вещество | растворитель |
|---|---|---|
| Смысл | Вещество, которое растворяется в растворителе в растворе, называется растворенным веществом; растворенное вещество присутствует в меньшем количестве, чем растворитель. | Вещество, которое растворяет растворенное вещество в растворе, называется растворителем; растворитель присутствует в большем количестве, чем растворитель. |
| Точка кипения | Температура кипения выше, чем у растворителя. | Это ниже, чем у растворенного вещества. |
| Физическое состояние | Найдено в твердом, жидком или газообразном состоянии. | В основном в жидком состоянии, но также может быть газообразным. |
| надежность | Растворимость зависит от свойств растворенного вещества. | Растворимость зависит от свойств растворителя. |
Определение растворенного вещества
Вещество, растворенное в растворе, называется растворенным веществом. Раствор может быть твердым, жидким или газообразным, хотя в основном это твердое соединение. Соль в морской воде, сахар в воде и кислород в воздухе — вот несколько типичных примеров растворенных веществ. Раствор растворяется в растворителе только тогда, когда силы притяжения между ними достаточно сильны, что может преодолеть молекулярные силы, удерживающие частицы, то есть частицы растворенного вещества и растворителя-растворителя вместе.
Хотя раствор содержит небольшое количество раствора, по сравнению с растворителем. Но в растворе существует условие, называемое насыщением, при котором растворитель больше не способен растворяться.
Пример растворенного вещества и растворителя можно объяснить, рассматривая чашку чая. Сухое молоко и сахар растворяют в горячей воде. Здесь горячая вода — это растворитель, а сухое молоко и сахар — это растворенные вещества.
Характеристики растворенного вещества
- Раствор имеет более высокую температуру кипения, чем растворитель.
- Они могут быть твердыми, жидкими или газовыми.
- При увеличении площади поверхности частиц растворенного вещества растворимость будет увеличиваться. Твердые частицы разбиваются на более мелкие кусочки.
- В случае газообразных растворенных веществ растворимость зависит от давления, помимо объема и температуры.
Определение растворителя
Раствор растворяется в растворителе. Его также можно определить как вещество, в котором различные вещества или соединения растворяются, превращаясь в раствор. Растворитель занимает основную часть раствора. Обычно это жидкости. Говорят, что вода является наиболее распространенным растворителем в повседневной жизни, поскольку она обладает способностью растворять любые (газ, твердые или жидкие) вещества и так же называется универсальным растворителем . Основное правило растворимости — « как растворить, как ».
Растворитель занимает основную часть раствора. Обычно это жидкости. Говорят, что вода является наиболее распространенным растворителем в повседневной жизни, поскольку она обладает способностью растворять любые (газ, твердые или жидкие) вещества и так же называется универсальным растворителем . Основное правило растворимости — « как растворить, как ».
Растворители можно разделить на полярные и неполярные.
Полярные растворители имеют высокую диэлектрическую проницаемость и имеют один или несколько электроотрицательных атомов, таких как N, H или O. Спирты, кетоны, карбоновые кислоты и амиды являются общими примерами функциональной группы, присутствующей в полярных растворителях. Полярные растворители состоят из полярных молекул и могут растворять только полярные соединения.
Полярный растворитель далее делится на полярные протонные растворители и полярные апротонные растворители. Вода и метанол являются полярными протонными молекулами, поскольку они способны образовывать водородную связь с растворенными веществами. С другой стороны, ацетон считается полярным апротонным растворителем, поскольку он не способен образовывать водородную связь с растворенным веществом, но создает диполь-дипольные взаимодействия с ионными растворенными веществами.
С другой стороны, ацетон считается полярным апротонным растворителем, поскольку он не способен образовывать водородную связь с растворенным веществом, но создает диполь-дипольные взаимодействия с ионными растворенными веществами.
Неполярные растворители содержат связи со сходными электроотрицательными атомами, такими как C и H. Они состоят из неполярных молекул и могут растворять неполярные соединения или растворенные вещества.
Характеристики растворителя
- Растворитель имеет низкую температуру кипения и легко испаряется.
- Растворитель существует только в виде жидкости, но также может быть твердым или газообразным.
- Обычно используемые растворители содержат углеродный элемент и поэтому называются органическими растворителями, тогда как другие называются неорганическими растворителями.
- Растворители имеют характерный цвет и запах.
- Ацетон, спирт, бензин, бензол и ксилол являются обычно используемыми органическими растворителями и имеют большое значение в химической промышленности.

- Растворители также используются при регулировании температуры в растворе, либо для поглощения тепла, выделяемого во время какой-либо химической реакции, либо для
увеличить скорость реакции с растворенным веществом.
Ключевые различия между растворенным веществом и растворителем
Ниже приведены основные различия между растворенным веществом и растворителем:
- Растворение может быть определено как вещество, которое растворяется растворителем в растворе, а вещество, которое растворяет раствор, называется растворителем . Следовательно, растворенное вещество присутствует в меньшем количестве, чем растворитель.
- Раствор может быть найден в твердом, жидком или газообразном состоянии, в то время как растворитель в основном находится в жидком состоянии, но может быть твердым или в газообразном состоянии.
состояние также. - Точка кипения выше растворенного вещества, чем растворителя. Свойства растворенного вещества и растворителя взаимозависимы.

Вывод
Растворители и растворители — это вещества, которые используются не только в химических лабораториях, но и являются частью повседневной жизни. Раствор содержит только два компонента: растворенный и растворяющий. Растворитель обладает способностью растворять растворенное вещество в гомогенном растворе.
Мы обсудили характеристики обоих веществ и пришли к выводу, что в одном растворителе могут быть разные типы растворенных веществ, которые могут образовывать гомогенный раствор.
Концентрация объемная: что такое и как правильно рассчитать
Концентрация растворов является важной характеристикой, показывающей содержание растворенного вещества и растворителя в его составе. Выражается концентрация, как правило, в массовых (вес) и объемных (объем) процентах или долях.
Растворы и их концентрация
Под раствором следует понимать однородную (гомогенную систему), в состав которой входит один или несколько компонентов. Растворы могут быть газовыми, жидкими, твердыми. Концентрация раствора бывает качественной и количественной. Качественная концентрация определяет растворы насыщенные, ненасыщенные, перенасыщенные. Количественная концентрация показывает массу или объем содержания веществ в составе раствора.
Концентрация раствора бывает качественной и количественной. Качественная концентрация определяет растворы насыщенные, ненасыщенные, перенасыщенные. Количественная концентрация показывает массу или объем содержания веществ в составе раствора.
Самый простой состав – это растворитель и растворенное вещество. Растворитель представляет собой вещество, которое при растворении не меняет свое состояние. Если смешиваются вещества в одинаковом агрегатном состоянии, к примеру, жидкость с жидкостью или газ с газом, растворителем будет компонент, которого больше. Образование раствора зависит от характера взаимодействия между частицами растворителя и растворенного вещества, их природой.
Чтобы определить соотношение растворенного вещества и растворителя в составе смеси и применяется такая характеристика, как концентрация. В зависимости от того, какая единица измерения выбрана, концентрация может быть объемной (содержание вещества в объеме раствора) или массовой (содержание вещества в единице массы раствора).
Объемные концентрации
Объемная доля вещества в общем объеме раствора выражается соотношением между объемом компонента, который нужно определить, и общим объемом всего раствора. Для измерения объемной концентрации используются доли или проценты. Значение концентрации указывается при определенных показателях температурного режима и давления.
Для выражения объемной доли используется следующая формула:
V(А) – объем вещества, V (смеси) – общий объем раствора.
Объемная доля, как правило, применяется в отношении газовых смесей. К примеру, содержание кислорода в воздухе составляет 21%, что означает объемную долю кислорода: φ(O2) = 21%. Применение объемной доли удобно потому, что объемное содержание газа в составе раствора газов, которые химически не взаимодействуют между собой, такая же, как молярная доля смеси. Это в достаточной мере точно выполняется, когда показатели давления и температуры не слишком высокие.
Для определения концентрации растворов определенных веществ используется ареометр. Он проградуирован непосредственно в концентрации смеси, а не в показателях ее плотности.
Он проградуирован непосредственно в концентрации смеси, а не в показателях ее плотности.
Объемная концентрация и объемная доля – безразмерные величины. Чтобы их выражать в большинстве случаев используются проценты, но могут также применяться такие единицы, как промилле, миллионные доли. Возможно также отображение единиц в таком виде: «% об.» или «об.%» (объемные проценты), однако рекомендуется писать конкретное указывать величину, к которой относится значение.
Вам могут быть интересны следующие товары
Вам могут быть интересны услуги
Растворитель и растворитель | Химия для неосновных
Цели обучения
- Определите решение.
- Определите растворенное вещество.
- Определите растворитель.
- Приведите примеры решений.
Снег — водный раствор?
Зимой температура часто опускается ниже точки замерзания воды. Это состояние может вызвать проблемы с радиаторами автомобиля. Если вода замерзнет, водяные шланги порвутся, блок двигателя может треснуть, а автомобилю может быть нанесен значительный ущерб.
Раствор и растворитель
Когда одно вещество растворяется в другом, образуется раствор . Раствор представляет собой гомогенную смесь, состоящую из растворенного вещества , растворенного в растворителе . Растворенное вещество — это вещество, которое растворяется, а растворитель — растворяющая среда. Растворы могут быть образованы с использованием многих различных типов и форм растворенных веществ и растворителей.
Мы знаем много типов решений. Посмотрите несколько примеров в таблице Table ниже.
Тип | Растворитель | Растворенное вещество | Пример |
газ / газ | азот | кислород | воздух |
газ / жидкость | вода | двуокись углерода | газированная вода |
жидкость / жидкость | вода | этиленгликоль | антифриз |
твердое / жидкое | вода | соли | морская вода |
Мы хотим сосредоточиться на решениях, в которых растворителем является вода. Водный раствор — это вода, содержащая одно или несколько растворенных веществ. Растворенные вещества в водном растворе могут быть твердыми веществами, газами или другими жидкостями. Некоторые примеры перечислены в Таблице выше. Другие примеры включают уксус (уксусная кислота в воде), алкогольные напитки (этанол в воде) и жидкие лекарства от кашля (различные лекарства в воде).
Водный раствор — это вода, содержащая одно или несколько растворенных веществ. Растворенные вещества в водном растворе могут быть твердыми веществами, газами или другими жидкостями. Некоторые примеры перечислены в Таблице выше. Другие примеры включают уксус (уксусная кислота в воде), алкогольные напитки (этанол в воде) и жидкие лекарства от кашля (различные лекарства в воде).
Рисунок 2. Типичное решение — четкое и стабильное. Бен Миллс (Викимедиа: Benjah-bmm27).
Для того, чтобы быть истинным решением, смесь должна быть стабильной.Когда сахар полностью растворяется в воде, он может стоять неопределенное время, и сахар не выпадет из раствора. Кроме того, если раствор сахара в воде пропустить через фильтр, он не изменится. Растворенные частицы сахара пройдут через фильтр вместе с водой. Это связано с тем, что растворенные частицы в растворе очень маленькие, обычно менее 1 нм в диаметре. Частицы растворенного вещества могут быть атомами, ионами или молекулами, в зависимости от типа растворенного вещества.
Сводка
- Раствор представляет собой гомогенную смесь растворенного вещества в растворителе.
- Растворенное вещество — это вещество, присутствующее в растворе в меньшем количестве.
- Растворитель — это материал, присутствующий в растворе в большем количестве.
Практика
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://www.chem.memphis.edu/bridson/FundChem/T13a1100.htm
- Как сахар растворяется в воде?
- Как ионные соединения растворяются в воде?
Обзор
- Какое решение?
- Что такое растворенное вещество?
- Что такое растворитель?
- Почему азот является растворителем в воздухе?
Глоссарий
- раствор: Гомогенная смесь, состоящая из растворенного вещества, растворенного в растворителе.Образовавшееся одно вещество растворяется в другом.
- растворенное вещество: Материал, присутствующий в растворе в меньшем количестве.

- растворитель: Материал, присутствующий в растворе в большем количестве.
Что такое решение?
Что такое решение? Какое решение?Раствор представляет собой гомогенную смесь одного или нескольких растворенных веществ, растворенных в растворителе.
- растворитель : вещество, в котором растворенное вещество растворяется с образованием гомогенной смеси
- растворенное вещество : вещество, которое растворяется в растворителе с образованием гомогенной смеси
Обратите внимание, что растворитель — это вещество, которое присутствует в наибольшем количестве.
Существует множество различных решений. Например, растворенное вещество может быть газом, жидкостью или твердым веществом. Растворителями также могут быть газы, жидкости или твердые вещества.
На следующих рисунках показано поведение нескольких различных типов растворов под микроскопом.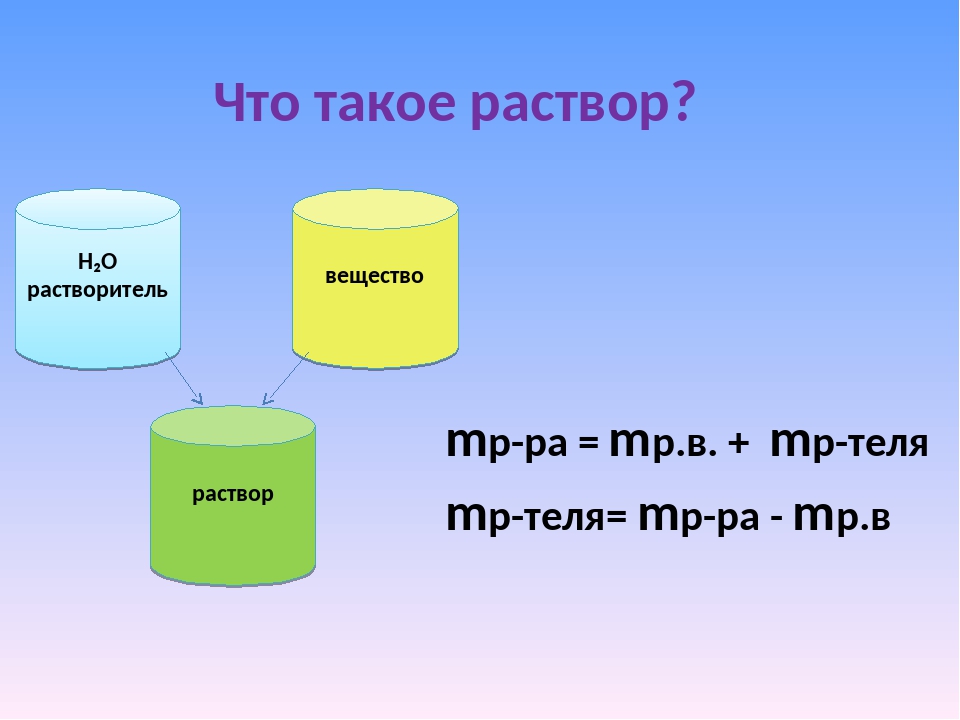 Обратите внимание, что в каждом случае частицы растворенного вещества равномерно распределяются среди частиц растворителя.
Обратите внимание, что в каждом случае частицы растворенного вещества равномерно распределяются среди частиц растворителя.
| Вид под микроскопом газа Br 2 (растворенного вещества), растворенного в газе Ar (растворитель). | Вид под микроскопом газообразного аргона (растворенного вещества), растворенного в жидкости H 2 O (растворитель). |
| Вид под микроскопом Br 2 жидкость (растворенное вещество), растворенное в жидкости H 2 O (растворитель). | Вид под микроскопом твердого NaCl (растворенного вещества), растворенного в жидкой H 2 O (растворитель). Обратите внимание, что твердое ионное вещество NaCl при растворении в воде образует ионы Na + (синий) и ионы Cl — (зеленый). Обратите внимание, что твердое ионное вещество NaCl при растворении в воде образует ионы Na + (синий) и ионы Cl — (зеленый). |
| Вид под микроскопом твердого Kr (растворенного вещества, , синий, ), растворенного в твердом Xe (растворитель, , красный, ). |
Chem4Kids.com: Matter: Solutions
Прежде чем мы погрузимся в растворы , давайте отделим растворы от других типов смесей. Растворы — это группы молекул, которые смешаны и равномерно распределены в системе.Ученые утверждают, что растворы представляют собой гомогенные системы . Все в растворе равномерно разложить и тщательно перемешать. Гетерогенные смеси имеют нечто большее (более высокую концентрацию) в одной части системы по сравнению с другой.

Давайте сравним сахар в воде (H 2 O) с песком в воде. Сахар растворяется и разливается по стакану с водой. Песок опускается на дно. Сахар-вода — это однородная смесь, а песок-вода — гетерогенная смесь.Оба являются смесями, но только сахар-вода также может называться раствором.
Довольно много. Растворы могут быть твердыми , растворенными в жидкостях. Когда вы работаете с химией или даже готовите на кухне, вы обычно растворяете твердые вещества в жидкости. Растворы также могут быть газами, растворенными в жидкостях, например газированной водой. Также могут быть газы в других газах и жидкости в жидкостях. Если вы перепутаете вещи, и они останутся в равномерном распределении, это решение. Вы, вероятно, не найдете людей, делающих твердые и твердые решения.Обычно они начинаются как твердые / газообразные / жидко-жидкие растворы, а затем затвердевают при комнатной температуре. Сплавы со всеми типами металлов являются хорошими примерами твердых растворов при комнатной температуре.
Простое решение — это, по сути, два вещества, которые равномерно смешаны друг с другом. Один из них называется растворенным веществом, а другой — растворителем. Растворенное вещество — это растворяемое вещество (сахар). Растворитель — это тот, который растворяет (вода). Как показывает практика, растворителя обычно больше, чем растворенного вещества.Будьте терпеливы со следующим предложением, когда мы сложим все вместе. Количество растворенного вещества, которое может быть растворено растворителем, определяется как растворимость . Это много «сол» слов. В науке всему есть особые названия. У них также есть названия для различных типов однородных смесей. Раствор — это общий термин, используемый для описания однородных смесей с мелкими частицами. Коллоиды — это растворы с более крупными частицами. Когда вы смотрите на коллоиды, обычно они кажутся туманными или молочными.Фактически, молоко представляет собой эмульгированный коллоид .

Вы также можете услышать о коллоидах, если изучите почву. В то время как молоко представляет собой органический коллоид , почвы могут состоять из неорганических коллоидов , таких как глина.
Подробнее о решениях в части II …
Водный круговорот в Водолее (видео NASA / GSFC)
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Раствор— Растворы, растворитель, растворенные вещества и вода
Раствор представляет собой однородную (однородную по всему объему) смесь на молекулярном уровне двух или более веществ.Он образуется, когда одно или несколько веществ растворяются в одном или нескольких других веществах. Научный характер решений — относительно недавнее открытие, хотя решения в той или иной форме использовались людьми на протяжении всей истории.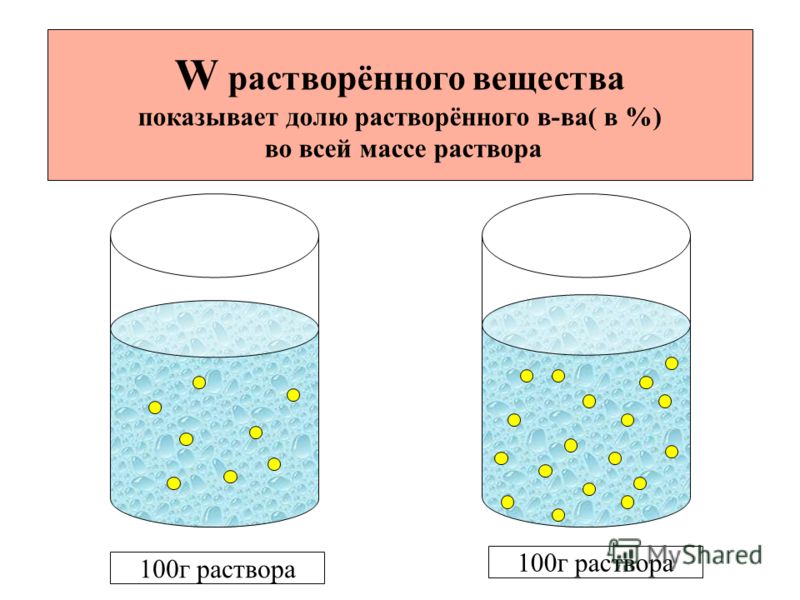
Вещества (твердые, жидкие или газообразные) в растворе состоят из двух фаз: растворителя и растворенного вещества. Растворитель — это вещество, которое обычно определяет физическое состояние раствора (твердое, жидкое или газообразное). Растворенное вещество — это вещество, растворенное растворителем.Например, в растворе соли и воды вода является растворителем, а соль — растворенным веществом.
Растворы образуются, потому что молекулы растворенного вещества притягиваются к молекулам растворителя. Когда силы притяжения растворителя превышают молекулярные силы, удерживающие растворенное вещество вместе, растворенное вещество растворяется. Нет никаких правил, которые будут определять, будут ли вещества растворяться, однако главное правило растворимости гласит: «подобное растворяется подобное».«Нефть и вода не смешиваются, но масло в масле смешиваются.
Вещества, составляющие раствор, могут быть твердыми, жидкими, газами или их комбинацией. Латунь представляет собой раствор твердого сплава , меди и цинка. Бензин — это комплексный раствор жидкостей. Воздух — это раствор газов. Газированная вода представляет собой раствор твердого сахара, жидкой воды и углекислого газа, газа. Свойства растворов лучше всего понять, изучая растворы с жидкими растворителями.
Латунь представляет собой раствор твердого сплава , меди и цинка. Бензин — это комплексный раствор жидкостей. Воздух — это раствор газов. Газированная вода представляет собой раствор твердого сахара, жидкой воды и углекислого газа, газа. Свойства растворов лучше всего понять, изучая растворы с жидкими растворителями.
Когда вода является растворителем, растворы называются водными растворами.В водных растворах растворенный материал часто разделяется на заряженные компоненты, называемые ионами. Например, соль (NaCl) ионизируется в ионы Na + и ионы Cl — в воде. Ионная природа жидких растворов была впервые определена Сванте Аррениусом (1859-1927), который в начале 1880-х годов изучил, как электричество проходит через раствор. Его ионная теория утверждает, что заряженные частицы в растворе будут проводить электричество. В то время, его теория была противоречивой и презираемым большинством ученых.Однако в конце 1890-х годов, когда ученые обнаружили, что атомов содержат заряды, ионная теория была принята.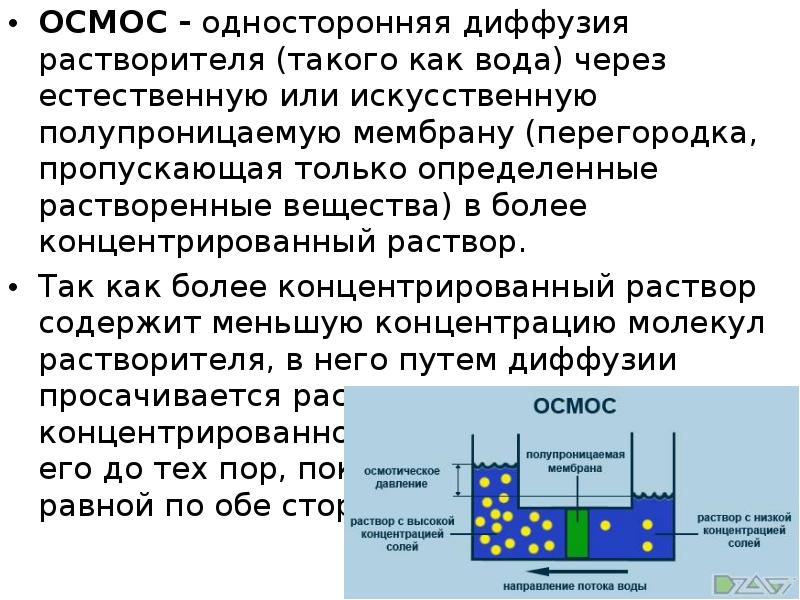 В 1903 году он был удостоен Нобелевской премии за свою работу по пониманию природы решений.
В 1903 году он был удостоен Нобелевской премии за свою работу по пониманию природы решений.
Из-за молекулярного взаимодействия физические свойства раствора часто отличаются от свойств чистых веществ, из которых они состоят. Например, вода замерзает при 32 ° F (0 ° C), но раствор воды и соли замерзает при температуре ниже 32 ° F. Поэтому соль тает , лед .
В отличие от чистых веществ, растворы не имеют определенного состава. Их состав зависит от количества растворенного вещества, растворенного в растворителе. Концентрированные растворы содержат относительно высокие количества растворенного вещества, растворенного в растворителе, тогда как разбавленные растворы имеют относительно низкие количества. Концентрация раствора обычно выражается в граммах растворенного вещества на литр растворителя. Концентрация раствора 0,2 унции (5 г) сахара в 3,5 унции (100 г) воды равна 0.05 или 5%.
Каждое растворенное вещество имеет определенную степень растворимости в растворителе. Растворимость — это число, которое указывает нормальную концентрацию при определенной температуре , при которой растворение больше не происходит. Например, если добавить чайную ложку сахара в стакана воды, он растворяется и образуется ненасыщенный раствор. Однако, если добавляется все больше и больше сахара, он в конечном итоге образует кучу нерастворенного сахара на дне стакана. В этот момент нормальная максимальная концентрация превышается и создается насыщенный раствор.
Растворимость — это число, которое указывает нормальную концентрацию при определенной температуре , при которой растворение больше не происходит. Например, если добавить чайную ложку сахара в стакана воды, он растворяется и образуется ненасыщенный раствор. Однако, если добавляется все больше и больше сахара, он в конечном итоге образует кучу нерастворенного сахара на дне стакана. В этот момент нормальная максимальная концентрация превышается и создается насыщенный раствор.
Растворимость растворенного вещества в растворителе зависит от различных факторов. Молекулярная структура, давление , давление и температура влияют на растворимость системы. Нагревание раствора может увеличить или уменьшить растворимость. Аналогичный эффект имеет повышение давления.
Раствор — важная форма , вопрос и основа многих продуктов, которые мы используем каждый день. От клея до шампуня, от соды до лекарств, растворы, несомненно, будут использоваться людьми навсегда.![]()
Решения
9.1 Решения
Цель обучения
- Поймите, что вызывает появление решений.
Раствор Другое название однородной смеси. — другое название однородной смеси. В главе 1 «Химия, вещества и измерения» смесь определяется как как материал, состоящий из двух или более веществ. В растворе комбинация настолько близка, что различные вещества невозможно различить визуально даже с помощью микроскопа.Сравните, например, смесь соли и перца и другую смесь, состоящую из соли и воды. В первой смеси мы легко можем увидеть отдельные крупинки соли и крупинки перца. Смесь соли и перца не раствор. Однако во второй смеси, как бы внимательно мы ни смотрели, мы не можем увидеть два разных вещества. Соль, растворенная в воде, представляет собой раствор.
Главный компонент раствора, называемый растворителем Главный компонент раствора, обычно представляет собой ту же фазу, что и сам раствор. Каждый второстепенный компонент раствора (а их может быть более одного) называется растворенным веществом. Второстепенный компонент раствора. В большинстве решений, которые мы опишем в этом учебнике, не будет двусмысленности относительно того, является ли компонент растворителем. или растворенное вещество.) Например, в растворе соли в воде растворенное вещество представляет собой соль, а растворитель представляет собой воду.
Каждый второстепенный компонент раствора (а их может быть более одного) называется растворенным веществом. Второстепенный компонент раствора. В большинстве решений, которые мы опишем в этом учебнике, не будет двусмысленности относительно того, является ли компонент растворителем. или растворенное вещество.) Например, в растворе соли в воде растворенное вещество представляет собой соль, а растворитель представляет собой воду.
Растворы бывают во всех фазах, и растворитель и растворенное вещество не обязательно должны находиться в одной и той же фазе для образования раствора (например, соли и воды).Например, воздух представляет собой газообразный раствор, состоящий примерно из 80% азота и примерно 20% кислорода, а некоторые другие газы присутствуют в гораздо меньших количествах. Сплав — твердый раствор металла с растворенными в нем другими веществами. представляет собой твердый раствор, состоящий из металла (например, железа) с растворенными в нем другими металлами или неметаллами. Сталь, сплав железа и углерода и небольшого количества других металлов, является примером твердого раствора. В таблице 9.1 «Типы решений» перечислены некоторые общие типы решений с примерами каждого из них.
Сталь, сплав железа и углерода и небольшого количества других металлов, является примером твердого раствора. В таблице 9.1 «Типы решений» перечислены некоторые общие типы решений с примерами каждого из них.
Таблица 9.1 Типы решений
| Фаза растворителя | Растворенная фаза | Пример |
|---|---|---|
| газ | газ | воздух |
| жидкость | газ | газированные напитки |
| жидкость | жидкость | этанол (C 2 H 5 OH) в H 2 O (алкогольные напитки) |
| жидкость | цельный | соленая вода |
| цельный | газ | H 2 газ, абсорбированный металлическим Pd |
| цельный | жидкость | Hg (ℓ) в зубных пломбах |
| цельный | цельный | стальные сплавы |
Что вызывает образование раствора? Простой ответ заключается в том, что растворитель и растворенное вещество должны иметь схожие межмолекулярные взаимодействия. В этом случае отдельные частицы растворителя и растворенного вещества могут легко смешиваться так тесно, что каждая частица растворенного вещества окружена частицами растворенного вещества, образуя раствор. Однако, если два вещества имеют очень разные межмолекулярные взаимодействия, требуется большое количество энергии, чтобы заставить их отдельные частицы тесно смешаться, поэтому раствор не образуется.
В этом случае отдельные частицы растворителя и растворенного вещества могут легко смешиваться так тесно, что каждая частица растворенного вещества окружена частицами растворенного вещества, образуя раствор. Однако, если два вещества имеют очень разные межмолекулярные взаимодействия, требуется большое количество энергии, чтобы заставить их отдельные частицы тесно смешаться, поэтому раствор не образуется.
Этот процесс приводит к простому практическому правилу: подобных растворяется, как . Очень полярные растворители растворяют очень полярные или даже ионные растворенные вещества.Неполярные растворители растворяют неполярные растворенные вещества. Таким образом, вода, будучи полярной, является хорошим растворителем для ионных соединений и полярных растворенных веществ, таких как этанол (C 2 H 5 OH). Однако вода не растворяет неполярные растворенные вещества, такие как многие масла и смазки (Рисунок 9.1 «Растворимость»).
Мы используем слово «растворимый» — растворенное вещество, которое растворяется в определенном растворителе. для описания растворенного вещества, которое растворяется в конкретном растворителе, и слово нерастворимое — растворенное вещество, которое не растворяется в конкретном растворителе.для растворенного вещества, которое не растворяется в растворителе. Таким образом, мы говорим, что хлорид натрия растворим в воде, но не растворим в гексане (C 6 H 14 ). Если растворенное вещество и растворитель являются жидкостями и растворимы в любой пропорции, мы используем слово смешиваемые жидкости, которые растворяются друг в друге, и слово несмешиваемые жидкости, которые не растворяются друг в друге. если их нет.
для описания растворенного вещества, которое растворяется в конкретном растворителе, и слово нерастворимое — растворенное вещество, которое не растворяется в конкретном растворителе.для растворенного вещества, которое не растворяется в растворителе. Таким образом, мы говорим, что хлорид натрия растворим в воде, но не растворим в гексане (C 6 H 14 ). Если растворенное вещество и растворитель являются жидкостями и растворимы в любой пропорции, мы используем слово смешиваемые жидкости, которые растворяются друг в друге, и слово несмешиваемые жидкости, которые не растворяются друг в друге. если их нет.
Пример 1
Вода считается полярным растворителем. Какие вещества должны растворяться в воде?
- метанол (CH 3 OH)
- сульфат натрия (Na 2 SO 4 ) Октановое число
- (C 8 H 18 )
Решение
Поскольку вода является полярной, в ней растворяются полярные или ионные вещества.
- Мы ожидаем, что из-за наличия группы ОН в метаноле его молекулы будут полярными. Таким образом, мы ожидаем, что он растворим в воде. Поскольку и вода, и метанол являются жидкостями, слово смешиваемый может использоваться вместо растворимый .
- Сульфат натрия — ионное соединение, поэтому мы ожидаем, что он растворим в воде.
- Как и другие углеводороды, октан неполярен, поэтому мы ожидаем, что он не будет растворяться в воде.
Упражнение по развитию навыков
Толуол (C 6 H 5 CH 3 ) широко используется в промышленности в качестве неполярного растворителя.Какие вещества должны растворяться в толуоле?
Упражнения по обзору концепции
Что вызывает образование раствора?
Как фраза « как растворяется как » относится к растворам?
ответы
Растворы образуются из-за сходных межмолекулярных взаимодействий растворенного вещества и растворителя.

Это означает, что вещества со схожими межмолекулярными взаимодействиями будут растворяться друг в друге.
Ключевые вынос
- Растворы образуются из-за сходных межмолекулярных взаимодействий растворенного вещества и растворителя.
Упражнения
Приведите несколько примеров решений.
В чем разница между растворителем и растворенным веществом?
Может ли раствор содержать более одного растворенного вещества? Вы можете привести пример?
Должен ли раствор быть жидким? Приведите несколько примеров, подтверждающих ваш ответ.

Приведите хотя бы два примера решений, обнаруженных в организме человека.
Какие вещества, вероятно, будут растворимы в воде, очень полярном растворителе?
- нитрат натрия (NaNO 3 )
- гексан (C 6 H 14 )
- изопропиловый спирт [(CH 3 ) 2 CHOH]
- бензол (C 6 H 6 )
Какие вещества, вероятно, будут растворимы в толуоле (C 6 H 5 CH 3 ), неполярном растворителе?
- нитрат натрия (NaNO 3 )
- гексан (C 6 H 14 )
- изопропиловый спирт [(CH 3 ) 2 CHOH]
- бензол (C 6 H 6 )
Растворимость спиртов в воде зависит от длины углеродной цепи.
 Например, этанол (CH 3 CH 2 OH) растворим в воде в любом соотношении, в то время как только 0,0008 мл гептанола (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH) растворяется в 100 мл воды. Предложите объяснение такому поведению.
Например, этанол (CH 3 CH 2 OH) растворим в воде в любом соотношении, в то время как только 0,0008 мл гептанола (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH) растворяется в 100 мл воды. Предложите объяснение такому поведению.Диметилсульфоксид [(CH 3 ) 2 SO] представляет собой полярную жидкость.Основываясь на информации из упражнения 9, что, по вашему мнению, будет в нем более растворимо — этанол или гептанол?
ответы
Растворитель является основным компонентом раствора; растворенное вещество является второстепенным компонентом раствора.

Раствор не обязательно должен быть жидким; воздух — это газообразный раствор, а некоторые сплавы — твердые растворы (ответы могут быть разными).
- вероятно растворимый
- вероятно не растворим
- вероятно растворим
- вероятно не растворим
Небольшие молекулы спирта имеют сильные полярные межмолекулярные взаимодействия, поэтому они растворяются в воде.
 В больших молекулах спирта неполярный конец подавляет полярный конец, поэтому они плохо растворяются в воде.
В больших молекулах спирта неполярный конец подавляет полярный конец, поэтому они плохо растворяются в воде.
Что такое растворенное вещество? Определение растворенного вещества и примеры
Растворенное вещество — это химическое вещество, которое растворяется в растворителе с образованием раствора. (фото: Полина Танкилевич)В химии растворенное вещество — это вещество, растворенное в растворителе, или часть химического раствора, присутствующая в меньшем количестве.Смешивание растворенного вещества и растворителя, приводящее к растворению растворенного вещества, что также известно как сольватация. Концентрация описывает количество растворенного вещества в растворителе или растворе. Например, концентрация 0,1 М HCl описывает раствор, состоящий из 0,1 моля соляной кислоты на литр раствора.
Термин «растворенное вещество» происходит от латинского слова Solutere , что означает «разрыхлять».![]() Слова «растворитель» и «растворять» также происходят от одного и того же слова.
Слова «растворитель» и «растворять» также происходят от одного и того же слова.
Хотя растворенные вещества чаще всего рассматриваются в жидких растворах, они также встречаются в газах и твердых телах.
Свойства растворенного вещества
Растворенное вещество проявляет характерные свойства в растворе:
- Распределение растворенного вещества однородно. То есть количество частиц растворенного вещества в объеме одинаково, независимо от того, где отбирается проба раствора.
- Частицы растворенного вещества не видны глазу.
- Растворенное вещество в растворе не рассеивает свет.
- Частицы растворенного вещества не выпадают из раствора и не могут быть отделены от раствора фильтрацией.
- В растворе растворенное вещество находится в той же фазе, что и растворитель.
Как определить, что является растворенным, а какой — растворителем
Растворенное вещество — это часть раствора, присутствующая в меньшем количестве, чем растворитель. Если вы знаете состав раствора, легко определить растворитель, поскольку он составляет наибольшую долю. Остальная часть раствора состоит из растворенного вещества. В растворе может быть более одного растворенного вещества.
Если вы знаете состав раствора, легко определить растворитель, поскольку он составляет наибольшую долю. Остальная часть раствора состоит из растворенного вещества. В растворе может быть более одного растворенного вещества.
В химической реакции растворенное вещество присутствует в меньшей мольной доле и растворяется в растворителе.Каждый раз, когда вы видите символ ( aq ) после химического вещества, вы знаете, что это растворенное вещество в водном растворе (воде).
Примеры растворенных веществ
Вот примеры растворенных веществ:
| Растворенное вещество | Раствор | Тип раствора | Растворитель |
| Соль | Морская вода | Твердое вещество, растворенное в жидкость | Вода |
| Сахар, растворенный диоксид углерода | Сода | Твердое вещество и газ, растворенные в жидкости | Вода |
| Кислород, водяной пар, углекислый газ, аргон | Воздух | Газ, растворенный в газе | Азот |
| Хром | Нержавеющая сталь | Твердое вещество, растворенное в твердом веществе | Железо |
| NaOH (гидроксид натрия) | 1. 0M NaOH ( вод. Вода 0M NaOH ( вод. Вода | ||
| Этан, пропан, бутан | Природный газ | Газ, растворенный в газе | Метан |
| Серебро, медь, индий | Стоматологическая амальгама | Твердое вещество, растворенное в твердом веществе | Ртуть |
Прогнозирование того, будет ли растворяться растворенное вещество
Растворимость — это мера того, сколько растворенного вещества растворяется в растворителе.Обычно полярные растворители растворяют полярные растворенные вещества, в то время как неполярные растворители растворяют неполярные растворенные вещества. Например, соль (полярная) растворяется в воде (полярная), но не в масле (неполярная). Растворимость зависит от нескольких факторов, включая температуру, давление и присутствие других веществ. Например, в кипящей воде растворяется больше соли, чем в ледяной.
Ссылки
- Clugston, M .

 (Гомогенизация растворов)
(Гомогенизация растворов)


 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.

 Например, этанол (CH 3 CH 2 OH) растворим в воде в любом соотношении, в то время как только 0,0008 мл гептанола (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH) растворяется в 100 мл воды. Предложите объяснение такому поведению.
Например, этанол (CH 3 CH 2 OH) растворим в воде в любом соотношении, в то время как только 0,0008 мл гептанола (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH) растворяется в 100 мл воды. Предложите объяснение такому поведению.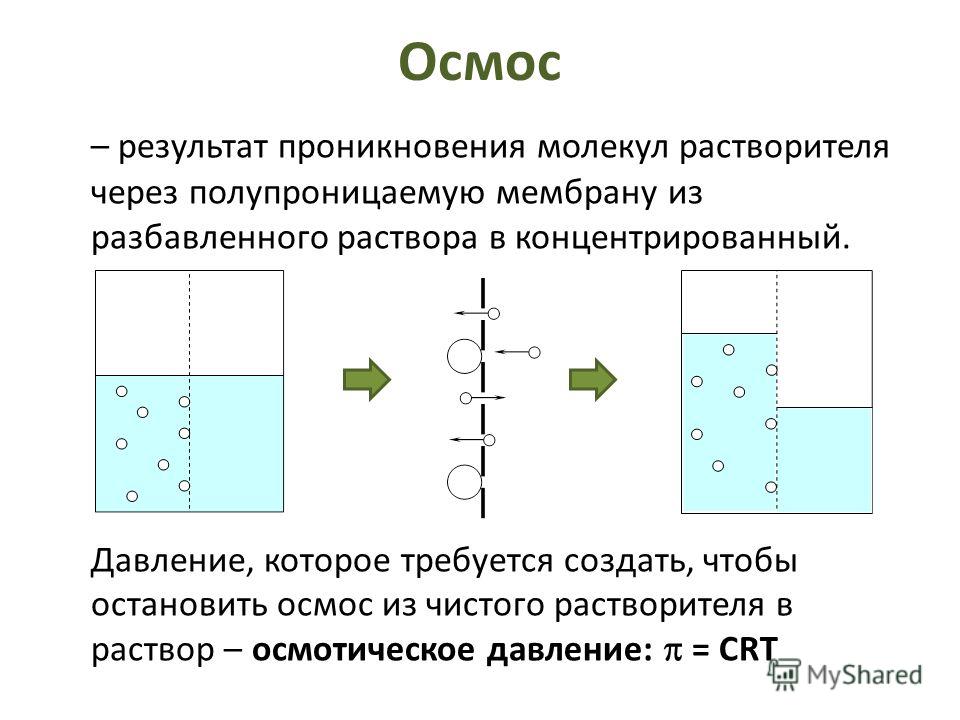
 В больших молекулах спирта неполярный конец подавляет полярный конец, поэтому они плохо растворяются в воде.
В больших молекулах спирта неполярный конец подавляет полярный конец, поэтому они плохо растворяются в воде.