Механизм химического никелирования сплавом никель-фосфор
Главная → Механизм химического никелирования

Заказать ХИМИЧЕСКОЕ НИКЕЛИРОВАНИЕ (сплав никель-фосфор) стали
Заказать ХИМИЧЕСКОЕ НИКЕЛИРОВАНИЕ (сплав никель-фосфор) алюминия
1. Общие сведения о химическом никелировании.
Процесс химического никелирования позволяет осаждать покрытия равномерной толщины с отклонениями не более 10% на деталях сложной конфигурации. По сравнению с никелевыми покрытиями, полученными гальваническим способом они обладают более высокой твердостью и износостойкостью, поэтому могут применяться для деталей, работающих в условиях трения, особенно при отсутствии смазки.
Покрытия имеют минимальную пористость и высокие декоративные свойства (особенно при осаждении из свежеприготовленного раствора), поэтому применяются в качестве защитно-декоративных.
Химическое никелирование обязательно выполняется в присутствии одного из сильных восстановителей. Самым распространенным является гипофосфит натрия. В основе процесса лежит реакция взаимодействия гипофосфита натрия с ионами никеля. Гипофосфит натрия гидролизуется в воде с образованием фосфита натрия и атомарного водорода по химической реакции:
NaH2PO2 + Н2О = NaH2PO3 + 2Нат.
Атомарный водород, адсорбированный на поверхности покрываемой детали, восстанавливает ионы никеля по химической реакции:
Ni2+ + 2Нат → Ni + 2Н+
Одновременно атомарный водород взаимодействует с анионами Н2РО2-1 и Н2РО3-1, восстанавливая фосфор до элементарного состояния, который в последствии входит в состав покрытия.
При химическом никелировании всегда выделяется водород:
2Нат → H2
На эту реакцию расходуется более 60 % выделяющегося по реакции водорода.
Реакция восстановления никеля является автокаталитической, т.е. для ее начала необходимо наличие катализатора. Каталитическими свойствами обычно обладает металл детали, например железо, титан, алюминий, а в дальнейшем — никель (отсюда и название механизма — автокаталитический т.е. никель сам провоцирует свой рост на покрываемой детали).
Наносить химический никель можно и на металлы, которые не являются катализаторами данной реакции: медь, серебро и др. В этом случае необходимы предварительный контакт детали с более отрицательным металлом, например с алюминием, или подача короткого импульса тока. На таких металлах, как свинец, кадмий, олово и др., покрытие получить невозможно. Химический никель наносят и на неметаллические материалы: стекло, керамику и пластмассу. Перед нанесением покрытия поверхность подвергают активированию известными методами.
Содержание фосфора в покрытии колеблется в пределах от 3 до 12 % и зависит от кислотности раствора, снижаясь с понижением рН. Возможно, это связано с тем, что скорость восстановления ионов никеля с ростом рН увеличивается быстрее, чем скорость восстановления фосфора.
На скорость химического никелирования оказывают влияние и такие факторы, как температура, концентрация и соотношение гипофосфита натрия и ионов никеля, природа и количество органических добавок.
Температуру рабочего раствора поддерживают равной 80-97 °С. При повышении температуры с 80 до 90 °С скорость осаждения увеличивается в 1,5 раза, а при снижении ее ниже 70 °С процесс осаждения полностью прекращается.
Химическое никелирование протекает при рН 4-4,5 и при рН 8-10, поэтому растворы, в которых происходит осаждение покрытия, делятся на кислые и щелочные. При рН<4 процесс осаждения прекращается. При рН>5,5 начинается гидролиз солей никеля, при этом частицы гидроксида никеля становятся центрами разложения рабочего раствора и может произойти «саморазряд» ванны — выделение металлического никеля во всем объеме раствора.
Так как во время химического никелирования все время выделяется кислота, необходимо вводить различные буферные добавки: уксусную кислоту, янтарную кислоту и т. п. Введение в раствор комплексообразователей препятствует образованию фосфита никеля, который, выпадая в осадок, делает его непригодным для дальнейшего использования.
Обычно раствор используют один раз, при этом 10-15 % исходных компонентов пропадает, а буферные добавки пропадают полностью. Однако из-за своей простоты этот способ широко применяется в промышленности, хотя его и нельзя назвать экологичным.
Кроме буферных добавок и комплексообразователей в растворы вводят в очень малых количествах специальные добавки-стабилизаторы, например катионы сурьмы, висмута и мышьяка.
В кислых растворах оптимальным отношением соли никеля к гипофосфиту натрия, выраженным в молях, является 0,4. Накопление фосфитов никеля оказывает вредное влияние на процесс осаждения: взвешенные частицы труднорастворимых фосфитов оседают на деталях, делая поверхность шероховатой.
Процесс протекает при температуре 80-100 °С. Так как кислотность раствора все время увеличивается из-за образования фосфористой кислоты, добавляют 1-2 %-ный раствор NaOH или 25 %-ный раствор Nh5OH (1:10).
Кислые растворы по сравнению со щелочными имеют ряд преимуществ: они более стабильны, имеют более высокую скорость осаждения и обладают более высокими защитными свойствами.
Щелочные растворы кроме солей никеля и гипофосфита натрия содержат комплексообразователи — аммиак и лимонную кислоту, что позволяет вести процесс осаждения длительное время. Растворимость фосфитов в щелочных растворах значительно выше, чем в кислых. Накапливающийся фосфит не оказывает вредного влияния при концентрации менее 340 г/л. В щелочных растворах можно наносить покрытие на коррозионно-стойкую сталь, алюминий, титан и т. п.
Покрытия, полученные при химическом никелировании, имеют слоистую аморфную структуру. Недостатком покрытия является его хрупкость, которая начинает проявляться при толщине слоя около 10 мкм и выше. После термической обработки покрытие становится кристаллическим и представляет собой твердый раствор никеля с небольшим содержанием фосфора и интерметаллическое соединение Ni3P. Содержание фосфора 4-8 % для щелочных и 8-10 % для кислых растворов.
Термическая обработка позволяет повысить микротвердость покрытий до 8400-11 800 МПа. Термическая обработка стальных деталей производится при температуре 300-400 °С, алюминиевых — при 275-280 °С, а деталей из дюраля — при 375-385 °С. Время выдержки 1 ч. Структурные превращения в покрытиях сопровождаются выделением тепла и изменением объема, поэтому при очень быстром нагреве возможно разрушение покрытий.
Сцепление никель-фосфорных покрытий сильнее сцепления электролитического никеля, так как осаждение происходит равномерно как внутри, так и снаружи детали, заполняя все микроуглубления и неровности. Отклонения толщин не превышают 10%, поэтому химический никель наносят на прецизионные детали, например на плунжерные пары топливных насосов двигателей, мелкие детали в часовой и оптической промышленности и т. п.
Высокие защитные свойства наряду с небольшой пористостью позволяют применять никель-фосфорные покрытия в качестве защитных, в том числе в условиях перегретого пара и воздуха, вплоть до 700 °С. Для увеличения износоустойчивости и снижения коэффициента трения никель-фосфорное покрытие наносят на трущиеся поверхности. Незаменимо покрытие в полевых условиях и в небольших мастерских для восстановления размеров изношенных деталей. Целесообразно нанесение покрытия на крупногабаритные детали.
Скорость осаждения при химическом никелировании колеблется в зависимости от состава электролита от 10 до 25 мкм/ч. Химическое никелирование проводят в проточных и непроточных растворах. В проточных растворах постоянство состава поддерживается при помощи циркуляции раствора по замкнутому циклу: из реактора, в котором происходит осаждение, в теплообменник, где раствор охлаждается до 55 °С, затем насосом перекачивается через фильтр, оттуда самотеком стекает в корректировочный бак и поступает в реактор. Установка снабжена приборами автоматического регулирования рН и температуры.
2. Кинетика процесса химического никелирования.
На рисунке 1 (а и б) приведена диаграмма Е-рН (Е — окислительно-восстановительный потенциал системы). Линии на диаграмме отражают равновесия определенных ОВ реакций в зависимости от рН раствора. На диаграмму нанесены состояния никеля (рисунок 1а), цитратного комплекса никеля (рисунок 1б) и гипофосфита, отвечающие равновесным реакциям, приведенным в таблице 2.
На рисунках 1а и
1б заштрихована область, в которой никель находится в восстановленном
(металлическом) состоянии, в гипофосфит — в окисленном, т. е. область
возможного протекания реакций ХОМ. Сравнение рисунков показывает, что в
присутствии лиганда (цитрат-иона) исчезают оксидные соединения никеля, а
область протекания реакции заметно расширяется как по потенциалам, так и
по интервалам рН.


a б
Рисунок 1 — Диаграмма Е-рН: а — для системы никель — вода, гипофосфит-вода, б - для системы никель — вода, цитратный комплекс никеля — вода, гипофосфит-вода. Номера кривых на диаграмме соответствуют номерам равновесий в табл. 2 состояния никеля (1 — 9) и состояния гипофосфита (10-14).
Таким образом, для организации процесса ХОМ требуется как минимум соль осаждаемого металла, лиганд, восстановитель и щелочь.
В
связи с тем, что величина рН существенно влияет как на термодинамику,
так и на кинетику процесса, в состав раствора ХОМ, как правило, вводится
буферная добавка.
Реакции ХОМ имеют топохимический характер,
т.е. протекают на границе раздела фаз: продукт реакции (металлопокрытие)
— реакционная среда.
Еще одна важная особенность, без которой невозможно длительное протекание реакции ХОМ – автокаталитический характер процесса, т. е. способность осаждаемого металла катализировать процесс восстановления.
Таблица 2 — Уравнения, описывающие равновесия в системах никель — вода и гипофосфит-вода.
|
№ |
Равновесие |
Уравнение, описывающее равновесие |
|
1 |
Ni2++2e + Ni |
E=-0,250+0,0295lg[Ni2+] |
|
2 |
Ni(OH)2+2H++2e =Ni+2H2O |
E=0,110-0,059lgpH |
|
3 |
Ni3O4+2H2O+2H++2e=3Ni(OH)2 |
E=0,897-0,059lgpH |
|
4 |
Ni3O4+H++2e=3Ni2++4H2O |
E=1,977-0,264pH-0,08861lg[Ni2+] |
|
5 |
2Ni2O3+2H++2e=2Ni3O4+H2O |
E=1,305 — 0,059 pH |
|
6 |
2NiO2+2H++2e=Ni2O3+H2O |
E=1,434 — 0,059 pH |
|
7 |
Ni(OH)2+2H+=Ni2++2H2O |
lg[Ni2+] = 12,18 — 2 pH |
|
8 |
NiO2+4H++2e=Ni2++2H2O |
E=1,593-0,118pH-0,0295lg[Ni2+] |
|
9 |
[NiCit]—+2e=Ni+Cit3- |
E=-0,37+0,295lg [NiCit—/Cit3-] |
|
10 |
H2PO3—+2H++2e=H2PO2—+H2O |
E=-0,31 — 0,059 pH |
|
11 |
HPO32-+3H++2e=H2PO3—+H2O |
E=-0,276 — 0,87 pH |
|
12 |
H2PO4—+2H++2e=H2PO3—+H2O |
E=-0,26-0,059pH+0,0295lg [H2PO4—]/[H2PO3—] |
|
13 |
HPO42-+2H++2e=HPO32-+H2O |
E=0,234-0,059pH+0,0295lg [HPO42-]/[HPO32-] |
|
14 |
PO43-+2H2O+2e=HPO32-+3OH— |
E=0,14 — 0,087 pH |
В ходе ХОМ зависимость между массой получаемого металла и временем осаждения имеет сложный вид (рисунок 2). После погружения детали в раствор в течение некоторого времени отсутствуют внешние признаки протекания реакции (участок 1). Видимое протекание реакции ХОМ начинается с некоторого момента Τ0.

Рисунок 2. Зависимость массы осаждаемого металла от времени (пояснения в тексте).
Отрезок времени между 0 и Τ0 носит название индукционного периода. Это время, необходимое для того, чтобы образовались устойчивые малые частицы твердого продукта, обладающие каталитической активностью. После его образования скорость осаждения быстро возрастает (участок II). Торможение процесса (участок III) объясняется выработкой реагентов в ограниченном объёме раствора. Если проводится корректировка раствора, торможения может и не быть.
Процесс ХОМ может быть организован
как однократный или как непрерывный. В первом случае процесс ведется в
ограниченном объеме раствора без корректировки по основным компонентам; в
результате их выработки скорость реакции постепенно падает, раствор
приходит в негодность. В этом случае для характеристики растворов вводят
термин “коэффициент использования”, т. е. отношение того количества
металла, которое реально осадилось из данного раствора, ко всему
количеству металла, содержащемуся в растворе. До недавнего времени
однократная организация процесса использовалась повсеместно. Более
прогрессивным является непрерывный процесс, когда проводится
периодическая или непрерывная корректировка раствора по расходуемым
реагентам. В этом случае срок службы раствора может быть продлен до
нескольких недель, а в идеале — и месяцев. Непременным условием
существования таких растворов является присутствие еще одного класса
компонентов раствора — стабилизаторов.
Стабилизаторы — это вещества, предотвращающие спонтанное протекание реакции в объеме раствора, благодаря чему удлиняется срок службы раствора. Они вводятся в раствор, как правило, в весьма малых концентрациях. Особенностью действия стабилизирующих добавок является то, что они тормозят образование зародышей металлической фазы на начальной стадии их образования, в особенности в объеме раствора. Стабилизаторами могут являться вещества самой разной природы: ПАВ, серо- и селенсодержащие соединения, соли тяжелых металлов, слабые окислители, комплексообразователи и др. Соответственно и механизм их действия может быть различным, например, связывание в комплекс или окисление продуктов, выпадающих в осадок. Чаще всего действие стабилизаторов объясняют их адсорбцией на поверхности частиц в объёме раствора и на покрываемой поверхности. При удачном подборе стабилизаторов они полностью тормозят реакцию в объёме и лишь частично снижают скорость реакции на рабочей поверхности. Наибольшего эффекта добиваются при одновременном использовании нескольких стабилизаторов разного типа.

В настоящее время для описания процесса ХОМ предложены два основных механизма: химический и электрохимический. Первый заключается в химическом взаимодействии восстановителя с восстанавливаемым ионом, при котором происходит непосредственный переход электронов от первого ко второму. Электрохимический механизм предполагает протекание на каталитической поверхности отдельных электрохимических реакций (анодного окисления восстановителя и катодного восстановления ионов металла) путем их сопряжения (рисунок 3)

Рисунок 3. Сопряжение катодного и анодного процессов в ходе ХОМ: 1 – катодное восстановление металла; 2 – анодное окисление восстановителя; Есм – смешанный потенциал (|ik|=|ia|).
Передача электронов осуществляется с обязательным участием поверхности. Движущей силой процесса является анодное окисление восстановителя, создающее отрицательный потенциал для восстановления ионов металла. Скорость всего процесса определяется способностью данного металла катализировать процесс анодного окисления восстановителя.
При сопряжении катодного и анодного процессов в отсутствие внешнего тока в системе устанавливается стационарное состояние, при котором абсолютные значения катодной и анодной плотности тока равны:
|ik | = |ia |,
ik + ia = 0,
а металл приобретает смешанный потенциал Есм. Эта плотность тока и определяет скорость реакции ХОМ. Если скорость процесса, найденная при сопряжении поляризационных кривых, равна реальной скорости металлизации, это служит подтверждением электрохимического механизма процесса. Однако в ряде случаев скорость осаждения металла в модельных системах заметно отличается от реальной, что свидетельствует о частичном или полном протекании процесса ХОМ по иному механизму.
Под химическим никелированием (ХН) понимают процесс никелирования изделий путем восстановления никеля из раствора с помощью содержащегося в растворе восстановителя.
В последнее время процессу ХН приписывают электрохимическую природу. Согласно этому механизму весь процесс восстановления Ni(II) гипофосфитом может быть представлен двумя сопряженными реакциями.
zctc.ru
| ПОЛЕЗНЫЕ ССЫЛКИ: БОНУСЫ ИНЖЕНЕРАМ!: МЫ В СОЦ.СЕТЯХ: | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / Водные растворы и смеси для обработки металлов. / / Водные растворы для нанесения и удаления металлических покрытий / / Водные растворы для химического никелирования.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
tehtab.ru
Никелирование, серебрение и золочение | Так делают
Установить в гараже аппаратуру для электрохимического покрытия металлами других металлов и диэлектриков (трансформатор, выпрямитель, измерительные приборы, ванна и т. п.) довольно проблематично.
Сейчас применяется метод химического покрытия металлов и диэлектриков (пластмасс, стекла, фарфора и т. п.) другими металлами.
Процесс химического покрытия отличается своей простотой. Действительно, для того чтобы покрыть металлическую деталь, например, никелем, не нужно городить сложную установку. Достаточно располагать источником огня (газ, примус и т.п.), эмалированной посудой и подходящими химикатами. Час, два- и детали покрыты плотным и блестящим слоем никеля.
В этой статье мы рассмотрим только: никелирование, серебрение и золочение металлов. Однако существует много рецептов химического покрытия металлов и диэлектриков медью, кадмием, оловом, кобальтом, бором, двойными и тройными сплавами.

Никелирование
В основу процесса химического никелирования положена реакция восстановления никеля из водных растворов его солей гипофосфитом натрия.
Плёнка никелевого покрытия получается блестящая или полублестящая. Структура покрытия — аморфная, из сплава никеля и фосфора. Плёнка никеля без термообработки слабо держится на поверхности основного металла, хотя ее твердость близка к твердости хромового покрытия.
Термическая обработка детали с никелевым покрытием, полученным химическим путем, в значительной степени увеличивает сцепление пленки никеля с основным металлом. Одновременно растет и твердость никеля, достигающая твердости хрома.
Термическая обработка детали с никелевым покрытием производится при температуре около 400°С в течение часа. При термической обработке закаленных стальных деталей с никелевым покрытием необходимо учитывать, при какой температуре эти детали отпускались, и не превышать ее. В этом случае термическую обработку производят при температуре 270- 300 °С с выдержкой до 3 ч.
Растворы для химического никелирования могут быть щелочными (рН- выше 6,5) и кислыми (рН- от 4 до 6,5).
Щелочные растворы. Их применяют при нанесении покрытий на коррозионностойкую сталь, алюминий, магний и диэлектрики. Покрытия, осаждаемые из щелочных растворов, имеют менее блестящую поверхность, чем полученные из кислых растворов. Но зато покрытия из щелочных растворов более прочно связаны с основой, чем из кислого.
У щелочных растворов есть еще один существенный недостаток- явление саморазряда. Оно наступает при перегреве раствора. Это мгновенное выпадение губчатой массы никеля из раствора, сопровождающееся выбросом кипящего раствора из ванны!
Регулировку температуры при отсутствии термометра можно вести по интенсивности газовыделения. Если газ выделяется не интенсивно, то можно быть уверенным, что саморазряда не будет.
Кислые растворы
Они находят применение при нанесении покрытий на детали из черных металлов, меди, латуни, особенно когда требуется высокая твердость, износостойкость и коррозионно защитные свойства поверхности, покрытой никелем.
Для справки. Воду для никелирования (и при нанесении других покрытий) берут дистиллированную (можно использовать конденсат из бытовых холодильников). Химреактивы должны применяться как минимум чистые (обозначение на этикетке — Ч).
Подготовка детали. Перед нанесением на основной металл каких-либо металлических пленок необходимо осуществить ряд подготовительных операций. Отполированную деталь обезжиривают, травят и декапируют.
Обезжиривание. Процесс обезжиривания металлических деталей проводят, как правило, когда эти детали только что обработаны (отшлифованы или отполированы) и на их поверхности нет ржавчины, окалины и других посторонних продуктов.
С помощью обезжиривания с поверхности деталей удаляют масляные и жировые пленки. Для этого применяют водные растворы некоторых химреактивов, хотя для этого можно использовать и органические растворители (трихлорэтилен, пентахлорэтан, растворители № 646 и № 648 и др.).
Обезжиривание в водных растворах проводят в эмалированной посуде. Заливают воду, растворяют в ней химреактивы и ставят на малый огонь. При достижении нужной температуры загружают в раствор детали. В процессе обработки раствор перемешивают. Ниже приводятся составы для обезжиривания (все дано в граммах на литр воды — г/л), а также рабочие температуры растворов и время обработки деталей.
Внимание! От качества проведения подготовительных операций в сильной степени зависит конечный результат всех работ.
Черные металлы обезжиривают в одном из растворов:
- Жидкое стекло (канцелярский силикатный клей) — 3—10, едкий натр (калий) — 20- 30, тринатрийфосфат — 25—30. Температура раствора — 70—90 °С, время обработки — 10—30 мин.
- Кальцинированная сода — 20, калиевый хромпик — 1. Температура раствора — 80—90°С, время обработки — 10—20 мин.
Медь и ее сплавы обезжиривают в одном из растворов:
- Едкий натр — 35, кальцинированная сода — 60, тринатрийфосфат — 15, препарат ОП-7 (или ОП-10). Температура раствора — 60—70 °С, время обработки 10—20 мин.
- Едкий натр (калий) — 75, жидкое стекло — 20. Температура раствора — 80—90 °С, время обработки — 40—60 мин.
Алюминий и его сплавы обезжиривают в следующих растворах:
- Жидкое стекло — 20—30, кальцинированная сода — 50—60, тринатрийфосфат — 50—60. Температура раствора — 50— 60 °С, время обработки — 3—5 мин.
- Кальцинированная сода — 20—25, тринатрийфосфат — 20—25, препарат ОП-7 (или ОП-10) — 5—7. Температура раствора — 70—80 °С, время обработки — 10— 20 мин.
Серебро, никель и их сплавы обезжиривают в растворах:
- Жидкое стекло — 50, кальцинированная сода — 20, тринатрийфосфат — 20, препарат ОП-7 (или ОП-10) — 2. Температура раствора — 70—80 °С, время обработки — 5-10 мин.
- Жидкое стекло — 25, кальцинированная сода — 5, тринатрийфосфат — 10. Температура раствора — 75—80 °С, время обработки — 15—20 мин.
Травление. Стандартная подготовка деталей под покрытие, обычно состоящая в обезжиривании и декапировании, вполне достаточна для большинства случаев. Однако для деталей, имеющих глухие отверстия, пазухи и т.п., необходимо проводить процесс травления.
Черные металлы травят в растворах:
- Серная кислота — 90—130, соляная кислота — 80—100, уротропин — 0,5. Температура раствора — 30—40 °С, время обработки — до 1 ч.
- Соляная кислота — 200, уротропин — 0,5. Температура раствора — 30—35 °С, время обработки — 15—20 мин.
Медь и ее сплавы травят в растворах:
- Серная кислота — 25—40, хромовый ангидрид — 150—200. Температура раствора — 25 °С, время обработки — 5—10 мин.
- Хромовый ангидрид — 350, хлористый натрий — 50. Температура раствора — 18— 25 °С, время обработки — 5—15 мин.
Алюминий и его сплавы травят в растворах:
- Едкий натр — 50—100. Температура раствора — 40—60 °С, время обработки — 5-10 с.
- Азотная кислота — 35—40. Температура раствора — 18—25 °С , время обработки — 3—5 с.
Декапирование. Этот процесс представляет собой удаление с поверхности металла различных пленок, мешающих осаждению металлов. Декапирование проводят непосредственно перед покрытием основного металла соответствующей пленкой другого металла.
Черные металлы декапируют в следующих растворах:
- Серная кислота — 30—50. Температура раствора — 20 °С, время обработки — 20—60 с.
- Соляная кислота — 25—45. Температура раствора — 20 °С, время обработки 15— 40 с.
Медь и ее сплавы декапируют в растворах:
- Серная кислота — 5. Температура раствора — 18—20 °С, время обработки — 20 с.
- Соляная кислота — 10. Температура раствора — 20—25 °С, время обработки — 10-15 с.
Алюминий и его сплавы декапируют в растворах:
- Азотная кислота — 10—15. Температура раствора — 20 °С, время обработки — 5-15 с.
- Едкий натр — 150, хлористый натрий — 30. Температура раствора — 30—40 °С, время обработки — 5—10 с.
После каждого процесса подготовки деталь промывают в горячей, а затем в холодной воде.
Никелирование меди и ее сплавов
Подготовленную (обезжиренную, протравленную и декапированную) деталь подвешивают в раствор для никелирования. Здесь есть одна тонкость, и если ею пренебречь, то процесс осаждения никеля не пойдет. Деталь должна быть подвешена в раствор на алюминиевой или железной (стальной) проволоке. В крайнем случае при опускании детали в раствор ее необходимо коснуться железным или алюминиевым предметом.
Эти «священнодействия» нужны для того, чтобы дать старт процессу никелирования, так как у меди меньший электроотрицательный потенциал по отношению к никелю. Только присоединение или касание детали более электроотрицательным металлом дает старт процессу.
Приводим состав некоторых известных растворов для химического никелирования меди и ее сплавов (все дано в г/л):
- Хлористый никель — 21, гипофосфит натрия — 24, уксуснокислый натрий — 10, сульфид свинца — 15 мг/л. Температура раствора — 97 °С, рН — 5,2, скорость наращивания пленки — 15 мкм/ч.
- Хлористый никель — 20, гипофосфит натрия — 27, янтарнокислый натрий — 16. Температура раствора — 95 °С, рН — 5, скорость наращивания — 35 мкм/ч.
- Сернокислый никель — 21, гипофосфит натрия — 24, уксуснокислый натрий — 10, малеиновый ангидрид — 1,5. Температура раствора — 83 °С, рН — 5,2, скорость наращивания — 10 мкм/ч.
- Сернокислый никель — 23, гипофосфит натрия — 27, малеиновый ангидрид — 1,5, сернокислый аммоний — 50, уксусная кислота — 20 мл/л. Температура раствора — 93 °С, рН — 5,5, скорость наращивания — 20 мкм/ч.
Здесь (и далее) сернокислый никель, хлористый никель и гипофосфит натрия — кристаллогидраты.
Для приготовления раствора для никелирования нужно растворить все компоненты, кроме гипофосфита натрия, и нагреть его до нужной температуры. Гипофосфит натрия вводится в раствор непосредственно перед завешиванием детали для никелирования. Этот порядок касается всех рецепторов, где имеется гипофосфит натрия.
Раствор для никелирования разводят в любой эмалированной посуде (миска, глубокая сковорода, кастрюлька и т.п.) без повреждений на поверхности эмали. Возможный осадок никеля на стенках посуды легко удаляется азотной кислотой (50%-ный раствор).
Допустимая плотность загрузки ванны — до 2 дм2/л.
Никелирование алюминия и его сплавов
Учтите, что для алюминия и его сплавов перед химическим никелированием проводят еще одну обработку (после всех подготовительных операций) — так называемую цинкатную.
Ниже приведены рецепты растворов для цинкатной обработки.
Для алюминия:
- Едкий натр — 250, окись цинка — 55. Температура раствора — 20 °С, время обработки — 3—5 с.
- Едкий натр — 120, сернокислый цинк 40. Температура раствора — 20 °С, время обработки — 1,2 мин.
Для литейных алюминиевых сплавов (силуминов):
- Едкий натр — 10, окись цинка — 5, сегнетова соль (кристаллогидрат) — 10. Температура раствора — 20 °С, время обработки — 2 мин.
Для деформируемых алюминиевых сплавов (дюралей):
- Хлорное железо (кристаллогидрат) — 1, едкий натр — 525, окись цинка — 100, сегнетова соль — 10. Температура раствора — 25 °С, время обработки — 30—60 с.
При подготовке растворов для цинкатной обработки поступают следующим образом. Отдельно в половине воды растворяют едкий натр, в другой половине — остальные химреактивы. Затем оба раствора сливают вместе.
После цинкатной обработки деталь промывают в горячей, а затем в холодной воде и завешивают в раствор для никелирования.
Ниже приведены четыре раствора для химического никелирования алюминия и его сплавов:
- Хлористый никель — 45, гипофосфит натрия — 20, хлористый аммоний — 45, лимоннокислый натрий — 45. Температура раствора 90 °С, рН — 8,5, скорость наращивания — 20 мкм/ч.
- Хлористый никель — 35, гипофосфит натрия — 17, хлористый аммоний — 40, лимоннокислый натрий — 40. Температура раствора — 80 °С, рН — 8, скорость наращивания — 12 мкм/ч.
- Сернокислый никель — 20, гипофосфит натрия — 25, уксуснокислый натрий — 40, сернокислый аммоний — 30. Температура раствора — 93 °С, рН — 9, скорость наращивания — 25 мкм/ч.
- Сернокислый никель — 27, гипофосфит натрия — 27, пирофосфат натрия — 30, карбонат натрия — 42. Температура раствора — 50 °С, рН — 9,5, скорость наращивания — 15 мкм/ч.
Говоря о химическом никелировании, нельзя не отметить следующее. Никелевое покрытие имеет хорошую смачиваемость припоями, что позволяет получить доброкачественную пайку с помощью мягких припоев. Обладая высокими защитными свойствами, они позволяют получать стойкие к коррозии паяные соединения.
Никелирование стали
Для никелирования стали можно использовать один из следующих рецептов:
- Хлористый никель — 45, гипофосфит натрия — 20, хлористый аммоний — 45, уксуснокислый натрий — 45. Температура раствора — 90 °С, рН — 8.5, скорость наращивания — 18 мкм/ч.
- Хлористый никель — 30, гипофосфит натрия — 10, хлористый аммоний — 50, лимоннокислый натрий — 100 Т
takdelayut.ru
Химическое никелирование деталей – всё о процессе и особенностях + Видео
Никелирование химическое — это сложный процесс, позволяющий покрыть изделия из практически любого металла тонким защитным слоем никеля, повысить при этом коррозионную стойкость и придать поверхности блестящий вид и твердость.
1 Процесс химического никелирования деталей
Свойство никеля создавать на своей поверхности тонкую оксидную пленку, устойчивую к действию кислот и щелочей, позволяет использовать его для антикоррозионной защиты металлов.
Основной метод, применяющийся в промышленности — гальваническое никелирование, но оно требует наличия достаточно сложного оборудования и подразумевает работу с кислотами и щелочами, пары которых выделяются во время работы и могут сильно навредить здоровью человека. Для покрытия стали, алюминия, латуни, бронзы и других металлов может быть применен химический способ, так как он прост в использовании, и этот процесс можно проводить в домашних условиях.
На сегодняшний день существует два основных метода покрытия металлических деталей никелем: гальваническое и химическое. Первый метод требует наличия источника постоянного тока — электролитической ванны с электродами и большого количества химических реактивов. Второй способ намного проще. Для его проведения требуется наличие мерной посуды и эмалированной емкости для нагрева реактивов. Несмотря на всю кажущуюся простоту, это довольно сложный процесс, который требует большого внимания и соблюдения правил безопасности. По возможности проводите реакции в хорошо проветриваемом помещении. Идеальным вариантом будет оборудование рабочего места вытяжкой, ни в коем случае не соединенной с общедомовой вентиляцией. При работе пользуйтесь защитными очками, не оставляйте емкость с реактивами без присмотра.

Покрытие металлических деталей никелем
Рекомендуем ознакомиться
Основные стадии для произведения химического никелирования следующие:
- Для того чтобы никель покрыл поверхность тонким и равномерным слоем, изделие предварительно шлифуют и полируют.
- Обезжиривание. Поскольку даже тончайшая пленка жира на поверхности обрабатываемого изделия может вызвать неравномерное распределение никеля по площади детали, последнюю обезжиривают в специальном растворе, состоящем из 25-35 г/л NaOH или KOH, 30-60 г кальцинированной соды и 5-10 г жидкого стекла.
- Деталь или изделие, которое необходимо покрыть никелем, промывают в воде, после чего на 0,5-1 минуту погружают в 5% раствор HCl. Данный шаг предпринимается для того, чтобы удалить с поверхности металла тонкий слой окислов, который будет значительно снижать адгезию между материалами. После протравки деталь снова промывают в воде, затем немедленно переносят в емкость с раствором для покрытия никелем.
Собственно никелирование производят при помощи кипячения металлического изделия в специальном растворе, который готовят следующим образом:
- берут воду (желательно — дистиллированную) из расчета 300 мл/дм2 площади поверхности детали, включая как внутреннюю, так и внешнюю;
- воду нагревают до 60°С, после чего растворяют в ней 30 г хлористого никеля (NiCl2) и 10 г уксуснокислого натрия (CH3COONa) на 1 л воды;
- температуру поднимают до 80°С и добавляют 15 г гипосульфита натрия, затем в емкость с раствором погружают обрабатываемую деталь.

Кипячение металлического изделия
После погружения детали, раствор нагревают до 90-95°С и поддерживают температуру на таком уровне в течение всего процесса никелирования. Если вы увидели, что количество раствора сильно уменьшилось, можно добавить в него предварительно нагретую дистиллированную воду. Кипячение должно проходить не менее 1-2 часов. Иногда для получения многослойного покрытия, изделия из металла подвергают серии коротких (20-30 минут) кипячений, после каждого из которых деталь достают из раствора, промывают и высушивают. Это дает возможность получить слой никеля из 3-4 прослоев, которые суммарно имеют большую плотность и качество, чем одинарный слой той же мощности.
Особенность покрытия стальных изделий в том, что никель осаждается самопроизвольно вследствие каталитического воздействия железа. Для осаждения защитного слоя на цветных металлах используется другой состав.
2 Никелирование цветных металлов и сплавов
Химическое никелирование цветных металлов позволяет создавать защитную пленку на поверхности латуни, меди и бронзы. Для этого деталь сначала обезжиривают раствором, состав которого указан в первом способе, причем снимать оксидную пленку с металла не обязательно. Раствор для никелирования готовят следующим образом: в эмалированную емкость наливают 10% раствор хлористого цинка (ZnCl2), который более известен под названием «паяльная кислота». К нему понемногу добавляют сернокислый никель (NiSO4) до такой концентрации, при которой раствор окрашивается в зеленый цвет. Состав доводят до кипения, после чего погружают деталь в него на 1,5-2 часа. После того как реакция закончится, изделие достают из раствора и помещают в емкость с меловой водой (готовится способом добавления 50-70 г мела в порошке на 1 литр воды), а затем промывается.

Раствор сернокислого никеля
Никелирование алюминия проходит по схожей технологии, но состав раствора немного другой:
- 20 г сернокислого никеля;
- 10 г натрия уксуснокислого;
- 25 г натрия фосфорноватистокислого;
- 3 мл тиомочевины концентрацией 1 г/л;
- 0,4 г фтористого натрия;
- 9 мл уксусной кислоты.

Обработка деталей из алюминия
Перед обработкой изделия из алюминия погружают в раствор каустической соды, концентрацией 10-15%, и нагретом до температуры 60-70°С. При этом происходит бурная реакция с выделением водорода, пузырьки которого очищают поверхность от окислов и загрязнения. В зависимости от степени загрязненности, детали выдерживают в очищающем растворе от 15-20 секунд до 1-2 минут, после чего промывают в проточной воде и погружают в никелирующий раствор.
3 Применение никелированных изделий
Вследствие никелирования значительно повышаются физико-механические и декоративные свойства металлических изделий. Никель имеет серебристо-белый цвет, на воздухе быстро покрывается незаметной человеческому глазу пленкой окислов, которые практически не меняют его внешнего вида, но при этом надежно защищают от дальнейшего окисления и реакций с агрессивной средой. Никелирование используется для защиты сталей, бронзы, латуни, алюминия, меди и других материалов.

Защита металлических изделий от окисления
Является катодной защитой. Это значит, что при повреждении целостности покрытия, металл начинает реагировать с внешней средой. Для повышения механических свойств защитного слоя, нужно наносить его, точно придерживаясь технологии и последовательности действий. Никель, нанесенный на поверхность со следами загрязнения и ржавчины, с большим количеством неровностей, может начать вспучиваться и отслаиваться в процессе эксплуатации.
Изделия, покрытые никелем, почти ни в чем не уступают хромированным — имеют похожий блеск и твердость. При больших размерах емкостей для химической реакции никелем можно покрывать довольно большие детали, например, автомобильные диски.
4 Основные выводы по теме
Никелирование придает металлу красивый блестящий вид, высокую коррозионную стойкость и повышает твердость поверхности. Детали, покрытые никелем, можно использовать для украшения столбов ограды, если такую предусматривает проект участка. Красиво выглядят и имеют длительный срок эксплуатации различные метизы — крепежные болты, скобы, элементы мебельной фурнитуры. Они могут быть использованы в условиях повышенной влажности, температуры и нагрузки — в местах, где сталь быстро ржавеет и теряет свойства.
Химическое никелирование можно произвести собственноручно, в условиях хорошо проветриваемого гаража или мастерской.

Красивый блестящий вид поверхности
Нежелательно делать описанные технологические операции на кухне, так как испарения любых химических веществ могут быть опасными для здоровья.
Покрытие никелем с помощью химических реактивов не требует высоких энергозатрат, в отличие от гальванического, но позволяет получить достаточно качественное, блестящее и твердое покрытие.
tutmet.ru
Никелирование в домашних условиях: химическое, гальваническое
Никелирование изделий из металлов позволяет не только защитить их поверхности от коррозии, но и создать на них блестящее покрытие. Такие изделия широко применяются при изготовлении сантехники, автомобильных запчастей, медицинских инструментов и т. д. В связи с этим многие люди задаются вопросом, можно ли выполнить никелирование стали в домашних условиях?
Технология никелирования металлов
Никелирование осуществляется путем нанесения на металлический предмет тонкого слоя никелевого покрытия. Покрыть никелем можно изделия из различных металлов, таких как:
- сталь;
- медь;
- титан;
- алюминий.
Существуют металлы, которые нельзя никелировать:
- олово;
- свинец;
- кадмий;
- сурьма.
Никелевое покрытие обеспечивает защиту изделия от воздействия влаги и различных агрессивных веществ. Часто его наносят в качестве слоя-основы перед хромированием деталей. После нанесения тонкой пленки никеля, напыления из серебра, золота и других металлов держатся более прочно.
В домашних условиях применяются способы, не требующие использования специализированного оборудования. Благодаря этому, никелирование стали, меди, алюминия в бытовых условиях доступно практически каждому человеку. Чтобы получить равномерное покрытие, необходимо предварительно подготовить деталь.
Преимущество никелирования
Как подготовить изделие к никелированию?
Подготовка изделия довольно трудоемкий процесс. Следует полностью исключить наличие коррозии, окислений и т. п. Подготовка проводится в несколько этапов.

Обработка пескоструйным аппаратом
Данный вид обработки можно выполнять как специализированным пескоструйным аппаратом, так и самодельным. Во время обработки нужно постараться убрать как можно больше посторонних наслоений с поверхности заготовки. Особое внимание следует обратить на труднодоступные места. Они должны быть очищены так же, как и другие участки поверхности.
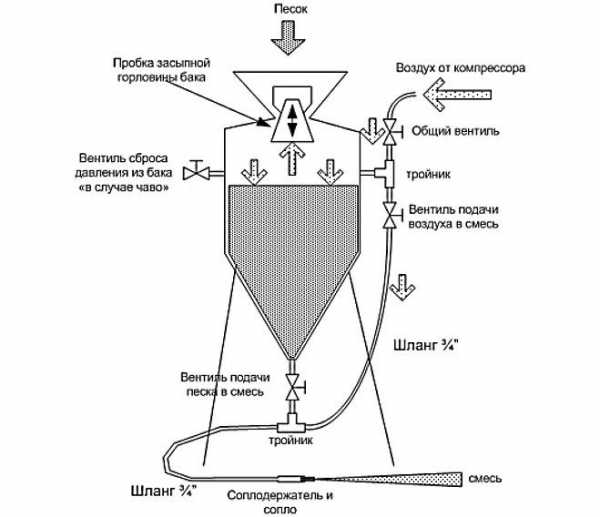
Общая схема пескоструйного аппарата
Шлифовка
Чтобы никелевое покрытие получилось равномерным, нужно максимально выровнять поверхность. Шлифовка дает возможность очистить предмет от оксидной пленки. Для выполнения этого этапа используется наждачная бумага, а также различные инструменты и приспособления, предназначенные для шлифовки.

До и после пескоструйной обработки
Совет: не стоит пренебрегать шлифовкой заготовок, неправильная подготовка может привести к отслоению покрытия.

Следующий этап подготовки металла — шлифовка
Устранение жировых загрязнений
После того, как процесс шлифовки окончен, следует смыть образовавшиеся загрязнения под проточной водой. Затем потребуется провести обезжиривание заготовки. Для этого можно использовать как готовые, так и самодельные растворители. После нанесения растворителя деталь нужно еще раз промыть водой и тщательно просушить.
Внимание: при выборе растворителя необходимо учитывать степень его воздействия на металл, из которого выполнено изделие. Запрещается применять обезжиривающие растворы, вступающие в химическую реакцию с поверхностью.

Обезжиривание металла
Омеднение
Никелирование изделия лучше проводить с предварительным омеднением заготовки. Этот этап не является обязательным, но никелирование стали и других металлов будет более качественным, если покрытие наносится на тонкий слой меди.

Омеднение в домашних условиях
Для омеднения детали необходимо поместить ее в стеклянную емкость с водным электролитом, состоящим из медного купороса и серной кислоты. Предмет подвешивается на проводе таким образом, чтобы он не касался стенок и дна емкости. По обе стороны от заготовки размещаются медные пластины, являющиеся электродами. После этого к электродам и заготовке подключается источник постоянного тока. Степень омеднения прямо зависит от времени проведения процесса.
Способы нанесения никелевого покрытия
Никелирование изделия в домашних условиях можно выполнить двумя способами: химическим и электролитическим.
Электролитический метод
Нанесение покрытия с использованием электролита называется гальваническим никелированием. Сначала потребуется подготовить водный раствор (электролит). Для этого необходимы следующие компоненты:
- сернокислый никель – 70 г;
- сернокислый магний – 15 г;
- поваренная соль – 2.5 г;
- сернокислый натрий – 25 г;
- борная кислота – 10г;
- вода – 500г.
Каждый из компонентов нужно отдельно растворить в воде и профильтровать. Полученные растворы смешивают и заливают в стеклянную емкость. Для гальванического никелирования в сосуд с электролитом помещают никелевые электроды. Чтобы покрытие на заготовке было равномерным, со всех сторон устанавливают не менее двух электродов.
Подготовленную заготовку помещают в сосуд между электродами таким образом, чтобы она не касалась стен и дна емкости. Электроды соединяют между собой медными проводниками, и подключают к плюсовому контакту источника постоянного тока. Токопроводящий провод подключают к минусовому выводу.
Схема установки для электролитического никелирования
В процессе никелирования стали напряжение питания не должно превышать 6 Вольт. Следует контролировать плотность тока, она не должна превышать 1,2 А. Процесс занимает около 30–40 минут. По его окончании, предмет нужно промыть проточной водой и тщательно просушить. Нанесенное покрытие должно получиться матовым и гладким. Чтобы поверхность изделия приобрела блеск, потребуется выполнить ее полировку.
Химический метод
Никелирование стали и других металлов химическим способом отличается от гальванического прочностью покрытия. При помощи химического никелирования можно легко нанести вещество даже на самые труднодоступные места.
Для выполнения процесса потребуется:
- янтарно-кислый натрий – 7.5 г;
- хлористый никель – 12.5 г;
- гипофосфит натрия – 15 г;
- вода – 500 мл.
В эмалированную посуду наливают воду и растворяют в ней янтарно-кислый натрий и хлористый никель. Затем раствор нагревают до температуры 90 градусов. По достижению требуемой температуры добавляется гипофосфит натрия. Изделие аккуратно подвешивается над емкостью с раствором. Количество жидкости рассчитывается исходя из того, что в 1 литре раствора можно покрыть поверхность площадью 2дм2.
Никелирование контролируется визуально: когда деталь равномерно покроется пленкой, процесс завершается. По окончании, деталь нужно промыть в растворе, изготовленном из воды и небольшого количества мела. После этого осуществляют сушку и полировку детали.

Как увеличить срок службы покрытия?
Полученное покрытие имеет пористую структуру. Поэтому металл изделия подвержен коррозии. Чтобы снизить риск ее возникновения, слой никеля покрывают смазочными составами. После их нанесения предмет погружают в емкость с рыбьим жиром. Спустя 24 часа, его излишки убирают при помощи растворителя.
Если изделие имеет крупные габариты, и погрузить его в емкость невозможно, то его поверхность просто натирают рыбьим жиром. Данную процедуру потребуется проводить дважды, с промежутком времени около 12 часов. Через 48 часов после обработки остатки жира нужно удалить.
Никелирование защищает металл от коррозии
Выполнить никелирование стали в домашних условиях можно двумя способами. Данный процесс является несложным, но требует тщательной подготовки и предельной аккуратности при выполнении. Необходимо приобрести качественные компоненты для приготовления раствора, заранее подготовить рабочую зону, емкости, инструменты и устройства.
В процессе работы важно соблюдать меры безопасности: защитить глаза и кожные покровы от попадания химических веществ, обеспечить достаточную вентиляцию помещения, предотвратить возможность воспламенения смеси и электрической установки.
Видео по теме: Химическая металлизация — никелирование
vtorexpo.ru
Химическое никелирование — ЭлектроХимия
Главная » Архив библиотека » Прочее » Химическое никелированиепо материалам «Гальванотехника для мастеров», Вирбилис
Этот процесс был в свое время одним из главных в технической специальной литературе, и казалось, что он создает сильную конкуренцию для традиционного электролитического никелирования. В настоящее время его оценивают более спокойно и применяют, когда для этого есть техническое и материальное обеспечение. Основным преимуществом никелевых покрытий, нанесенных химическим путем, является однородная толщина независимо от формы изделия. Это характерно для всех процессов осаждения металла без применения тока. Особенностью химического никелирования является непрерывное осаждение слоя, что создает возможность образования покрытий любой толщины. Ванны для химического никелирования состоят из соли никеля, гипофосфита натрия и добавок. Основой являются соли никеля и гипофосфит натрия. Существуют две разновидности ванн для химического никелирования — кислая и щелочная. В качестве солей никеля, в основном, применяют сульфат или хлорид никеля относительно небольшой (~5 г/л) концентрации. Содержание гипофосфита достигает 10—30 г/л. Добавки вводятся в виде комплексообразующих соединений, ускоряющих осаждение никеля, и стабилизаторов, препятствующих разложению электролита. В качестве комплексообразующих соединений в специальной литературе упоминаются гликолевая, молочная, лимонная и аминоуксусная кислоты. Ускоряющими являются янтарная, малоновая, пропионовая, масляная, валериановая и другие кислоты. Для стабилизации служат в основном соединения свинца, тиосульфат, тиомочевина и т.д. Ниже приведены примеры двух ванн для химического никелирования, г/л:|
Ванна |
1 |
2 |
|
Сульфат никеля (NiS04•7Н2О) |
20—30 |
— |
|
Ацетат натрия (CH3•COONa•3H2O) |
10—15 |
— |
|
Молочная кислота (CH3CHOHCOOH) |
25—30 |
— |
|
Тиомочевина (H2NCSNH2) |
0,0005—0,001 |
— |
|
Гипофосфит натрия (Na2HPO2•H2O) |
15—20 |
15—25 |
|
Хлорид аммония (NH4Cl) |
— |
30—40 |
|
Цитрат натрия (Na3C6H5O7•5,5H20) |
|
30—50 |
|
Аммиак (NH4OH) |
|
70-100 |
|
Хлорид никеля (NiCl2•6H2O) |
|
20—30 |
Ванна 1 кислая, лучше всего работает при рН = 4,3—4,8. Рабочая температура ванны 85—90 °С должна поддерживаться во время всего процесса никелирования. Для регулирования рН служит разбавленный (например, 5 %-ный) раствор едкого натра. Готовят ванну 1 следующим образом: в дистиллированной воде, нагретой до температуры 60 °С, сначала растворяют ацетат натрия, затем сульфат никеля и добавляют молочную кислоту, предварительно нейтрализованную едким натром до рН = 3,5—4,0. Нагрев ванну до 85 °С, добавляют гипофосфит натрия. После этого можно приступить к никелированию. Концентрация тиомочевины очень мала и в условиях мастерской нет возможности взвешивания с точностью до долей грамма. Так как избыток тиомочевины может привести к полной задержке процесса никелирования, лучше полностью отказаться от этого стабилизатора и воспользоваться ванной без тиомочевины. Ванна 2 щелочная. В дистиллированной воде, нагретой до 60 °С, растворяют цитрат натрия, хлориды аммония и никеля, добавляют порциями при постоянном перемешивании раствор аммиака с целью достижения рН = 8—9.
При этом происходит заметное изменение цвета раствора с зеленоватого на голубой. После подогрева до 80 °С добавляют гипофосфит и ванна готова к эксплуатации.
Приведенная информация очень общая и мало отражает практическую сторону никелирования. При менее 80 °С эффективность ванны очень низка. При 90 °С получают в течение 1 ч слой никеля толщиной 10—20 мкм. При дальнейшем повышении температуры, например, до 95°С получают более толстые слои, но стабильность ванны снижается. В определенный момент может наступить внезапное разложение ванны, что сопровождается появлением черного порошка на дне и стенках ванны. Такая ванна непригодна для дальнейшего использования. Серьезной проблемой является выбор соответствующих рабочих емкостей. В промышленных условиях применяют сложные установки из коррозионностойкой стали, тогда как для никелирования в малом объеме в основном служат стеклянные, фарфоровые или эмалированные емкости. Наилучшим способом нагрева малых и средних емкостей является водяная рубашка. Опустим 5 л стеклянный сосуд в эмалированный 10 л бак с водой, мы можем получить водяную рубашку, пригодную для газо- или электронагрева ее до температуры кипения. В стеклянном сосуде можно достичь температуры 83—85 °С, достаточной для проведения процесса. Высокая температура и сильное газовыделение на поверхности изделий фиксируется обслуживающим персоналом по сильному неприятному запаху. Очевидно, что вся установка должна находиться под вытяжкой. Как видно, вся процедура непроста, вследствие чего применение химического никелирования ограничено теми случаями, когда неприменимы электролитические методы. Например, металлические сильфоны в виде цилиндрической гармошки, применяемые для измерения давления при пневморегулировке, невозможно никелировать электролитически из-за сложной геометрической формы. Химическое никелирование является прекрасным решением этой проблемы. Стальные изделия можно никелировать химически без затруднений. На меди и латуни осаждение никеля начинается после кратковременного контакта с менее благородным металлом, например, железом или алюминием. Для никелирования алюминиевых сплавов обычно применяют щелочные ванны (например ванну 2).На стенках и дне сосуда, применяемого для химического никелирования, могут оседать мелкие частички никеля, в особенности, если поверхность сосуда не очень гладка, имеет царапины. Перед дальнейшим использованием такого сосуда необходимо устранить осевшие частички никеля, растворяя их в азотной кислоте.
echemistry.ru
Химическое осаждение никеля. Технология никелирования в домашних условиях.
С ценами на работы по никелированию, Вы можете ознакомиться в .
Нанесение никеля, также как и меди, является одним из обязательных процедур при подготовке изделия под целевое финишное покрытие. Электролитов для нанесения никеля существует множество. Он разнятся по способам применения, режимам, качеству покрытия и составам. Если Вы решили заниматься гальваникой, без никелирования Вам не обойтись.
Сам по себе никель не часто является целевым покрытием. В качестве антикоррозионного покрытия он не является лучшим кандидатом, в это случае больше подойдут цинк и хром, ввиду их химических свойств и способности «оттягивать» окисление железа, склонного к ржавчине, на себя. Как декоративное покрытие никелирование используется чаще, но в ввиду его химической нестойкости, при необходимости наносить цвет «белого» металла, чаще выбирают покрытие палладием или родием.
На нашем предприятии используются гальванический никель и химический (иммерсионный) никель.
Наиболее простой раствор для никелирования –
Раствор кислого (подслойного) никелирования.
Электролит кислого никелирования применяется в качестве первого металлического покрытия после очистки и полировки изделия. Его можно считать «клеем» или основой, на которую потом положим все остальные металлы. Толщина покрытия из такого раствора не превышает 1 мкм, а скорость осаждения 1-2 мкм/мин. Длительность выдержки в ванне кислого никелирования не больше 1 минуты. Это связано с тем, что кислый никель дает хрупкие и темные осадки на больших толщинах. Но, тем не менее, положить тонкий слой кислого никеля необходимо. Некоторые компоненты его состава обеспечивает микроразрушения поверхности для качественной адгезии покрытия, вместе с тем, нанося тонкий слой свежего никеля, мы обеспечиваем хорошее качество адгезии для следующего покрытия медью или блестящим никелем. Электролит кислого никелирования очень стабилен во времени и стоек к загрязнениям.
Электролит блестящего никелирования.
Электролит блестящего никелирования применяют для микровыравнивания поверхности изделия. По сравнению с блестящей медью, он дает менее зеркальные осадки. Скорость нарастания толщины и рабочая плотность тока также значительно ниже, но этот электролит необходим для финишной обработки изделий. Его обязательно используют для получения финишных осадков толщиной до 15 мкм. Или, при толщине покрытия 3-6 мкм как качественную подложку под гальваническое или иммерсионное золото.
Очень хорошие результаты этот раствор демонстрирует в барабанных и колокольных ваннах.
Электролит химического (иммерсионного) никелирования.
Химическое никелирование применяется при обработке сложнопрофильных изделий. Работает без приложения внешнего тока. Равномерное наращивание ненапряженного никеля во всех точках поверхности изделия, обеспечивает твердое, полублестящее покрытие. Часто этот раствор применяют для защиты от коррозии путем наращивания никеля в толщину 6-30 мкм. Применение химического никелирования ограничивается исходным материалом детали. Химическое никелирование – раствор горячий, что не всегда позволяет использовать его для пластиков. Также, в процессе работы,
cityshin.ru