Меднение алюминия в домашних условиях | ДОМ СОВЕТОВ
И снова здравствуйте!
Меднение алюминия в домашних условияхНа просторах интернета, нашел интересный способ покрытия алюминиевых поверхностей, слоем меди. Иначе говоря, меднение. Думаю это может пригодиться любителям самоделок и домашним мастерам.
Для проведения этого «алхимического» процесса, нам понадобятся:
Дистиллированная вода
Обычная водопроводная не подойдет, потому что в ней много не нужного нам хлора.Меднение алюминия в домашних условиях
Серная кислота
Для данной процедуры вполне сгодится электролит для авто аккумуляторов. Да и найти сейчас чистую серную кислоту, не так-то просто.Меднение алюминия в домашних условиях
Медный купорос.
Лучше брать строительный или промышленный.Меднение алюминия в домашних условияхПотому что в нем нет ненужных примесей, которые могут быть в садовом купоросе.
Пищевой желатин
Он нужен для придания блеска готовому изделию. Если на пальцах, то желатин замедляет осаждение меди, из-за чего происходит сглаживание поверхности.Меднение алюминия в домашних условиях
Медная проволока, в качестве электрода и так же медная проволока для крепления детали.
Диаметр проволоки для электрода где-то 5мм, так же можно использовать фольгу или какую-нибудь медную деталь.Меднение алюминия в домашних условиях
Блок питания, напряжением 5 вольт.
Подойдет от обычной зарядки для сотового телефона. Только ток не должен превышать 1А, иначе покрытие будет слишком рыхлым и неустойчивым.
А так же резиновые перчатки
Потому как кислота.Меднение алюминия в домашних условияхНо если у вас где-то завалялись запасные руки, то можно обойтись и без них.
Ну и желательно средство защиты дыхания, например респиратор.
Для замера используемых материалов, пригодится пластиковый мерный стакан, со шкалой. Или весы.
Меднение алюминия в домашних условияхНу а теперь, сам процесс.
Для начала нужно отмерить 200 мг дистиллированной воды и нагреть ее.
Нагревать воду, нужно потому что медный купорос лучше разводится в горячей воде.
После того как вода подогрелась, в ней нужно развести 100 гр. медного купороса и хорошенько размешать.
Следующим шагом, нужно отмерить 100гр. электролита и добавив в раствор медного купороса, все еще раз хорошо перемешать.
Теперь надо отмерить 1 гр. желатина и развести его горячей дистиллированной водой. И потом так же добавить в раствор с медным купоросом.
После этого надо в получившийся раствор добавить еще дистиллированной воды, чтобы получилось 0,5 литра.
В зависимости от величины обрабатываемой детали, нужно подбирать соответствующую пластиковую емкость, в которую нужно поместить электрод, сделанный из толстой медной проволоки. Он послужит анодом.Меднение алюминия в домашних условиях
Если раствора нужно больше, то следуя указанным выше пропорциям, подготавливается нужное количество раствора.
Меднение алюминия в домашних условияхПеред меднением заготовку нужно на 15-20 сек. поместить в средство Крот, чтобы удалить пленку оксида алюминия и обезжирить поверхность.
Меднение алюминия в домашних условияхА затем поместить изделие в гальванический раствор. И подключить плюсовой провод блока питания на анод (это конструкция из толстой медной проволоки), а на катод, то есть саму деталь, нужно подключить минусовой провод.
Меднение длится порядка двух часов, в зависимости от площади поверхности, которую нужно обработать.
После этого, в отдельной емкости, нужно развести немного соды с водой и промыть омедненную деталь.
Содовый раствор нейтрализует действие кислоты.
Далее деталь нужно зачистить металлической щеткой с мягким ворсом.
Лучше всего использовать с бронзовым ворсом.Меднение алюминия в домашних условиях
На этом процесс меднения закончен.
Как видите, ничего сложного в этом нет, а результат просто превосходный.
Меднение алюминия в домашних условияхТак что смело пробуйте и всё у вас получится. Удачи!
Меднение и лужение алюминия — Другие методы обработки
кстати.
если уж и есть горячее желание подпаятся к алюминию во многих точках и нужен именно ПОС в качестве припоя то ни в коем случае медь в качестве подслоя применять нельзя. адгезии нет. радикально лучше нанести химникель из любого раствора химникелирования с но добавить 2-3 грамма на литр любого фторида ( натрия, калия, аммония) рН раствора 5.5-3.5
смысл- фториды разрушают окисную пленку на алюминии и никель осаждается непосредственно на металл а не на окисел. потом можно паять обычным ПОС61, соединение очень прочное и гарантированное. Целесообразно отжечь пленку при 200 градусов 1-2 часа.процесс давно применяется в аппаратуре военного назначения
Попробовал этот метод.
Использовал следующий раствор: сернокислый никель 25г/л, натрий уксуснокислый 10г/л, натрий фосфорноватистокислый 20 г/л, натрий фтористый 5 г/л.
Процесс осаждения на алюминий идет, причем достаточно интенсивно. Однако пленка получается рыхлая и шершавая и адгезия стремится к нулю (можно сдуть при обдуве детали сжатым воздухом).
Наиболее неприятно что покрытие неравномерное — где-то вообще не хочет ложиться. Грешу на неправильную подготовку поверхности.
Подготовку поверхности делаю травлением в едком натре, затем осветление в азотной кислоте.
Притом на сталь и медь, подвешенные рядом пленка садится идеальная. Гладкая и крепкая.
Сам раствор тоже ведет себя нестабильно. Чуть перегреешь и процесс запускается на дне эмалированной кастрюли. Хоть и грею на водяной бане.
Заметил что алюминий начинает пузыриться раньше, чем сталь и медь. Может для него пониже температура раствора нужна?
Дайте пожалуйста рекомендации — как получить качественную пленку?
Гальваническое меднение, меднение алюминия, технологии
Гальваническое меднение изделий из металла
Нанесение тонкого слоя меди на изделия из никеля, латуни, цинка и других видов металла применяется для придания им различных свойств. Чаще всего гальваническое меднение осуществляется для следующих целей:
- подготовки поверхности к дальнейшей обработке
- повышения защитной способности
- в качестве промежуточного слоя в декоративных целях
- повышения электропроводности
- восстановления изношенных деталей
В качестве самостоятельного покрытия меднение не используют ни в декоративных целях, ни в качестве защиты от коррозии.
Гальваническое меднение как технология придания металлическим деталям и изделиям определенных характеристик имеет широкое применение в различных отраслях промышленности – электроэнергетике, радио- и приборостроении, нефтегазовой отрасли, авиастроении, автомобилестроении и т.д. Нередко эта технология используется для восстановления изношенных частей автомобилей и других технических средств. В гальванопластике меднение применяется для изготовления ювелирных изделий, сувенирной продукции, создания барельефов, при реставрационных работах и т.д. Зачастую без процесса меднения невозможно придать устройству или прибору требуемые свойства. Например, гальваническое меднение плат формирует токоведущий слой, который определяет ключевые эксплуатационные свойства, определяет такие свойства как устойчивость к термоударам, перепайкам, ремонтопригодности и т.д.
Гальваническое меднение алюминия и других металлов на производственном предприятии «Прибой»
Меднение имеет высокую популярность не только в промышленности, но и в быту. Нередко для личных целей меднение выполняется в домашних условиях, однако для решения производственных задач гальваническое меднение металла может и должно выполняться исключительно на специализированном оснащенном предприятии, таком как ПАО «Прибой». Для выполнения этого процесса обработки используются гальванические ванные с автоматизированным оборудованием и химической аппаратурой. Кроме того, для утилизации химических отходов, используемых для этой технологии, требуется разрешение.
Нередко для личных целей меднение выполняется в домашних условиях, однако для решения производственных задач гальваническое меднение металла может и должно выполняться исключительно на специализированном оснащенном предприятии, таком как ПАО «Прибой». Для выполнения этого процесса обработки используются гальванические ванные с автоматизированным оборудованием и химической аппаратурой. Кроме того, для утилизации химических отходов, используемых для этой технологии, требуется разрешение.
Также важно понимать, что состав, который применяется для нанесения слоя меди, тип меднения и другие параметры, при которых выполняется эта обработка изделия, должны подбираться исключительно с учетом того, на какой металл наносится слой меди, какие задачи требуются от изделия и какими свойствами должно оно обладать при эксплуатации. Так, например, гальваническое меднение алюминия в значительной степени отличается от нанесения тонкого слоя меди на другие металлы.
Разобраться в многообразии способов гальванического меднения, технологии подготовки нужного раствора и других деталях этого покрытия, сможет только квалифицированный специалист, имеющий за плечами богатый опыт работы и в арсенале современные производственные мощности.
Производственное предприятие «Прибой» качественно и оперативно выполнит услуги по нанесению гальванического покрытия. Мы работаем как с серийным производством, так и индивидуальными заказами. Стоимость услуг зависит от сложности, объема и требования заказчика к результату. Для получения подробной информации, пожалуйста, обращайтесь по телефону +7 (812) 328-44-20 или заполните форму обратной связи.
Меднение в домашних условиях
Современная техника выдвигает жесткие требования к характеристикам конструктивных элементов, во многих случаях эти задачи решает химическое меднение. Использование специальных покрытий поверхностей деталей выгодно экономически, так как гальваническое меднение позволяет понизить металлоемкость изделий из дорогостоящих металлов.
Блок: 1/3 | Кол-во символов: 329
Источник: https://plast-product.ru/galvanicheskoe-mednenie/
Цель меднения металлов и сферы их применения
Медь обладает совокупностью свойств, которые определяют условия ее применения при меднении металлов и неметаллических материалов. Она пластична, легко поддается полировке, а гальванический слой после меднения практически не имеет пор. По этой причине медные покрытия очень часто используют в качестве подслоя при хромировании и никелировании изделий, которые эксплуатируются в условиях постоянных сжатий и растяжений. Пластичность меди является идеальным условием для ее применения в гальванопластике. Толстослойное меднение художественных изделий и сложных моделей позволяет создавать их абсолютно точные копии, которые не трескаются и не деформируются при снятии с оригинала.
Она пластична, легко поддается полировке, а гальванический слой после меднения практически не имеет пор. По этой причине медные покрытия очень часто используют в качестве подслоя при хромировании и никелировании изделий, которые эксплуатируются в условиях постоянных сжатий и растяжений. Пластичность меди является идеальным условием для ее применения в гальванопластике. Толстослойное меднение художественных изделий и сложных моделей позволяет создавать их абсолютно точные копии, которые не трескаются и не деформируются при снятии с оригинала.
Медь обладает лучшей среди недрагоценных металлов электропроводностью и хорошо паяется. Поэтому меднение стальных изделий широко используется в радиотехнике и электротехнике при изготовлении проводников, контактов, деталей антенн и волноводов. В условиях применения высокочастотных сигналов на медное покрытие приходится большая плотность тока (скин-эффект), что снижает общее сопротивление проводника.
Еще одна область использования меднения — это создание тонких проводников на поверхностях пластмассовых изделий, а также покрытие пластика токопроводящими слоями.
Блок: 2/6 | Кол-во символов: 1285
Источник: https://WikiMetall.ru/metalloobrabotka/mednenie-v-domashnih-usloviya.html
Видео урок по меднению пули своими руками
Блок: 2/4 | Кол-во символов: 46
Источник: http://BoldProject.ru/raznoe/mednenie-v-domashnix-usloviyax.html
Особенности процесса
Покрытие, формируемое на обрабатываемой детали при помощи гальваники, может наноситься в технологических целях либо выполнять декоративные, защитные или сразу обе функции. В декоративных целях создают тонкий слой золота или серебра, а чтобы обеспечить надежную защиту поверхности обрабатываемой детали от коррозии, выполняют цинкование или гальваническое меднение.
Схема процесса электролиза
Сделать гальванику даже в домашних условиях несложно. Выполняют такую процедуру следующим образом.
- В диэлектрическую емкость с электролитом опускают два анода, подключаемые к плюсовому контакту источника электрического тока.

- Само обрабатываемое изделие, подключаемое к минусовому контакту источника электрического тока и, таким образом, выступающее в роли катода, помещается в электролите между анодами.
- Гальванизация, то есть процесс переноса молекул металла с электролита на изделие-катод, начинает происходить в тот момент, когда замыкается полученная электрическая сеть.
В результате на обрабатываемой поверхности формируется тонкий и однородный слой металла, который изначально содержался в химическом составе электролита.
Схема гальванической установки
Блок: 2/10 | Кол-во символов: 1291
Источник: http://met-all.org/obrabotka/himicheskaya/galvanika-domashnih-usloviyah-svoimi-rukami-hromirovanie-mednenie.html
Характеристики омедненных металлов
Медь имеет хорошее сцепление практически со всеми металлами и сплавами, но защитные свойства медного гальванического покрытия без дополнительных слоев невысоки. Под воздействием атмосферных факторов оно достаточно быстро разрушается, и даже в домашних условиях его обычно покрывают лаком. В то же время подслой из меди значительно улучшает характеристики многослойных покрытий в части механической прочности и коррозионной стойкости. Нержавеющие стали обычно защищают от коррозии трехслойным покрытием из хрома, никеля и меди. При этом меднение проводится первым, чтобы при использовании изделия в условиях переменных нагрузок обеспечить пластичность всего составного слоя. Точно такую же роль меднение играет в покрытиях металлопроката и листового железа, из которых изготавливают профильные изделия, эксплуатируемые в условиях морского климата и агрессивных сред. Омедненные провода и контакты из алюминия легко паяются и имеют более низкое сопротивление, особенно на высоких частотах. Технические условия электролиза позволяют при меднении металлов в декоративных целях окрашивать поверхностные слои меди в различные цвета и придавать им дополнительный блеск (на фото ниже – меднение по нержавейке).
Под воздействием атмосферных факторов оно достаточно быстро разрушается, и даже в домашних условиях его обычно покрывают лаком. В то же время подслой из меди значительно улучшает характеристики многослойных покрытий в части механической прочности и коррозионной стойкости. Нержавеющие стали обычно защищают от коррозии трехслойным покрытием из хрома, никеля и меди. При этом меднение проводится первым, чтобы при использовании изделия в условиях переменных нагрузок обеспечить пластичность всего составного слоя. Точно такую же роль меднение играет в покрытиях металлопроката и листового железа, из которых изготавливают профильные изделия, эксплуатируемые в условиях морского климата и агрессивных сред. Омедненные провода и контакты из алюминия легко паяются и имеют более низкое сопротивление, особенно на высоких частотах. Технические условия электролиза позволяют при меднении металлов в декоративных целях окрашивать поверхностные слои меди в различные цвета и придавать им дополнительный блеск (на фото ниже – меднение по нержавейке).
Блок: 3/6 | Кол-во символов: 1236
Источник: https://WikiMetall.ru/metalloobrabotka/mednenie-v-domashnih-usloviya.html
Необходимые инструменты
«Ингредиенты», без которых процесс не состоится, реально подготовить самим. Наши специалисты
утверждают, что прежде всего, нужны:
- Источник постоянного тока.Выбирается в зависимости от размера изделия.
- Аноды. Анодные пластины выполняют несколько функций. В первую очередь, они подводят в электролит ток, во-вторых, они возмещают убыль металла, уходящего на покрытие изделия.
- Рабочий электролит. Кислотный, щелочной или пирофосфорный раствор. Состав электролита выбирается в зависимости от исходного металла. Необходимо помнить, что любой электролит не универсален и подойдет не для всех работ.
Блок: 3/8 | Кол-во символов: 621
Источник: https://6mkm.ru/nashi-tehnologii/mednenie/mednenie-v-domashnih-usloviyah/
Подготовка материала
Как правильно подготовить простой электролит меднения
Стоит отметить, что химические реактивы для меднения найти непросто. Компании, реализующие подобные продукты, не продают их без специальных документов. Но вы можете сделать все сами.
Компании, реализующие подобные продукты, не продают их без специальных документов. Но вы можете сделать все сами.
Электролит в домашних условиях возможно приготовить только при условии точного соблюдения рецептуры. В состав простейшего электролита входит:
- Дистиллированная вода (или бидистиллят).
- Медный купорос.
- Соляная или другая кислота.
Готовый раствор имеет яркий синий цвет, запаха нет. Допускается наличие некоторого осадка. Важно соблюдать все меры безопасности с химическими реактивами: защита рук и глаз в первую очередь. Одежду, на которую случайно мог пролиться раствор, – лучше перевести в разряд дачной.
Хранить такую жидкость лучше в стеклянных бутылках или пластиковых канистрах. Обязательно следует указать дату розлива и название раствора. Правильное хранение компонентов избавит вас от возможных проблем. Приготовление электролита должно проходить в чистой пластмассовой или стеклянной посуде.
Подготовка материала
Химическое меднение является альтернативой электрохимическому способу, но не всегда может его заменить. В этом процессе важно тщательно подготовить деталь, бесследно устранив царапины, загрязнения, сколы и т.д. Для того, чтобы обезжирить вещь, можно пускать в ход и чистые растворители, и обезжиривающие растворы.
В этом процессе важно тщательно подготовить деталь, бесследно устранив царапины, загрязнения, сколы и т.д. Для того, чтобы обезжирить вещь, можно пускать в ход и чистые растворители, и обезжиривающие растворы.
При этом универсального метода нет – разные виды материалов подвергаются очистке по-разному:
- Сталь. Обезжиривать сталь можно раствором из едкого натрия и едкого калия при 70-90 градусов по Цельсию. Это займет около 20-30 минут. Будьте аккуратны, пользуйтесь вытяжкой.
- Медь и сплавы. Обезжиривание осуществляется едким натрием, нагретым предварительно до 40°, около 10 минут.
- Чугун. Для процесса обезжиривания нужен раствор из едкого натра, жидкого стекла, карбоната натрия и фосфата натрия при нагревании до 90°.
- Вольфрам. Меднение вольфрама в домашних условиях начинается с чистки предмета от грязи и прочих дефектов наждачной бумагой.
Блок: 4/8 | Кол-во символов: 2030
Источник: https://6mkm. ru/nashi-tehnologii/mednenie/mednenie-v-domashnih-usloviyah/
ru/nashi-tehnologii/mednenie/mednenie-v-domashnih-usloviyah/
Меднение деталей в растворе с электролитом
Для металлических деталей можно выполнить меднение в домашних условиях. Рассмотрим меднение, с опусканием детали в раствор с электролитом. Для этого необходимо иметь:
- небольшие медные пластины,
- несколько метров токопроводящей проволоки;
- источник тока, с напряжением до 6 В;
- рекомендуется также использовать реостат, для регулирования тока и амперметр.
Порядок работы
- В качестве жидкости, хорошо растворяющей медь, применяется обычный электролит. Его можно купить или приготовить в домашних условиях. Для этого потребуется 3 мл серной кислоты, на каждые 100 мл дистиллированной воды. Необходимый раствор, можно получить, добавив в полученный электролит до 20 гр. медного купороса.
- Перед началом процесса меднения детали, ее необходимо очистить наждачкой, чтобы снять оксидную пленку с поверхности.

- Затем, деталь обезжиривается горячим содовым раствором, и промывается чистой водой.
- В стеклянную емкость, нужного объема, наливается приготовленный раствор электролита.
- Затем, туда опускаются две медные пластины, на токопроводящих проводах. Между двумя медными пластинами подвешивается, предназначенная для меднения в домашних условиях деталь, на аналогичном проводе. Необходимо проследить, чтобы медные пластины и деталь были полностью залиты раствором электролита.
- На следующем этапе, концы проводов от медных пластин подсоединяются к плюсовой, а обрабатываемая деталь к минусовой клеммам источника тока. Последовательно, в созданную электрическую цепь нужно подсоединить реостат и амперметр. После включения тока в цепи, он реостатом устанавливается в пределах 15 мА на 1 см? площади поверхности детали.
- Выдержав, обрабатываемую деталь в растворе, в пределах 15-20 минут, нужно выключить электропитание и извлечь изделие из раствора. За этот непродолжительный промежуток времени, поверхность детали покроется тонким слоем меди.
 Толщина покрытия будет зависеть от продолжительности процесса меднения. Таким образом, можно достичь меднения поверхности любого изделия слоем в 300 мкм и более.
Толщина покрытия будет зависеть от продолжительности процесса меднения. Таким образом, можно достичь меднения поверхности любого изделия слоем в 300 мкм и более.
Блок: 3/4 | Кол-во символов: 2041
Источник: http://BoldProject.ru/raznoe/mednenie-v-domashnix-usloviyax.html
Меднение изделия
Перед началом работ по меднению в домашних условиях нужно подготовить необходимые материалы и оборудование. Надо позаботится об источнике напряжения и постоянного тока. Существует много рекомендаций касательно силы тока, разброс которого может быть большим. Поэтому желательно иметь реостат с возможностью плавной регулировки напряжения и для постепенного завершения процесса. Источником может служить автомобильный аккумулятор или выпрямитель с напряжением на выходе не больше 12 вольт. Для первых опытов будет достаточно обычной батарейки от 4.5 до 9 вольт.
Затем выбирается ёмкость для электролитического раствора, лучше всего из жаропрочного стекла. В любом случае все ёмкости для электролиза должны быть диэлектриками и выдерживать температуру не менее, чем 80 градусов по Цельсию.
В качестве анодов подойдут два больших медных листа. Они должны перекрывать по размеру заготовку. Из химических реактивов потребуются:
- Купорос медный.
- Кислота соляная либо серная.
- Вода дистиллированная.
Меднение в домашних условиях пользуется заслуженной популярностью, поскольку очень хорошо и надежно держится на стальных изделиях. Главное условие — правильно соблюдать технологию процесса.
Имеется два способа нанесения меди на поверхность:
- Помещение заготовки в раствор электролита.
- Неконтактный способ. В этом случае изделие не погружается в раствор.
Метод погружения
Подготавливается и обрабатывается поверхность изделия при помощи тонкого наждака и щеточки. После этого деталь моется в проточной воде, обезжиривается и еще раз промывается.
Этапы процесса омеднения следующие:
- Два медных анода подключают в сеть к положительным контактам и размещают их в стеклянную банку.

- К обработанному изделию подводят контакт с отрицательным значением напряжения и свободно подвешивают между анодами.
- Подключают реостат согласно электрической схеме для возможности регулирования силы тока.
- Подготавливается раствор в правильных пропорциях. На 100 г дистиллированной воды надо 20 г медного купороса и 2−3 г соляной кислоты. Вместо соляной кислоты можно использовать другую.
- Раствор выливается в посуду с медными пластинами и деталью таким образом, чтобы они полностью скрылись под поверхностью раствора.
- Подключается источник напряжения. Реостатом добиваются необходимой силы тока из примерного расчета 10−15 миллиампер на каждый квадратный сантиметр площади детали.
Весь процесс занимает примерно 15−20 минут. После обязательного выключения источника питания и остывания раствора готовое изделие с медным слоем на поверхности вынимается из банки.
Покрытие медью без погружения
Этот метод интересен тем, что его можно использовать для обработки не только стальных предметов, но и сделанных из других материалов.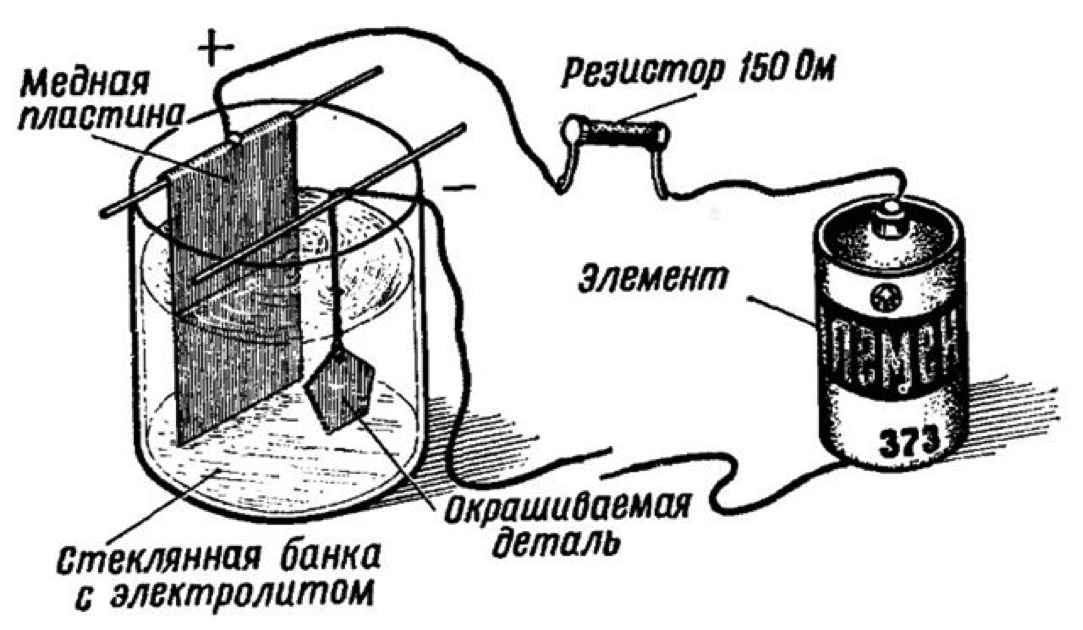 Например, алюминия и цинка. Порядок процесса следующий:
Например, алюминия и цинка. Порядок процесса следующий:
- Из многожильного медного провода изготавливается «кисточка». Конец провода оголяется. Из медных проводков создается подобие кисточки, чтобы затем прикрепить ее к деревянной ручке-держателю.
- Второй конец провода подключается к плюсовому контакту электрической цепи.
- В широкую ёмкость заливается стандартный электролитный раствор из медного купороса и соляной кислоты.
- Предварительно очищенная и промытая металлическая заготовка присоединяется к отрицательному контакту и размещается в пустой ёмкости.
- Импровизированная кисточка окунается в раствор электролита и проводится по поверхности заготовки без контакта. Это действие повторяется до получения результата.
Когда деталь полностью покроется слоем меди, выключается блок питания и процесс завершается. Деталь ополаскивается в воде и просушивается.
com/embed/RVbR6LBkHdA»/>
Обработка алюминия
Часто с помощью медного электролиза обновляют столовые приборы, сделанные из алюминия. Если нет опыта проведения этого процесса, то можно потренироваться нанести медь на алюминиевые пластинки. Порядок проведения процесса:
- Алюминиевую пластинку зачищают и обезжиривают.
- Наносят на неё небольшое количество раствора медного купороса.
- Подсоединяют отрицательную клемму от источника питания к алюминиевой пластинке. Удачным способом соединения является металлический зажим-крокодил.
- Положительный полюс питания подается на медную «щеточку». Это конструкция из медного провода, один конец которого освобожден от оплетки, а медные щетинки образовали кисточку. Зажим от питания присоединяется ко второму концу провода. Сечение провода должно быть от одного до полутора миллиметров.
- Медную щетину обмакивают в раствор сернокислой меди и водят на близком расстоянии от поверхности алюминиевой пластинки.
 При этом нужно стараться не прикасаться щеточкой к заготовке, чтобы не замкнуть цепь.
При этом нужно стараться не прикасаться щеточкой к заготовке, чтобы не замкнуть цепь. - Омеднение происходит буквально на глазах.
- После окончания работы с пластины удаляют остатки не закрепившейся меди и протирают спиртом.
Блок: 6/7 | Кол-во символов: 4745
Источник: https://tokar.guru/samodelkin/mednenie-galvanikoy-i-galvanoplastika-v-domashnih-usloviyah.html
Как правильно подготовить изделие к процедуре
Предметы, которые подлежат гальванизации, должны иметь очищенную от коррозии и грязи поверхность. Ручной механической очисткой или шлифовальными приборами поверхность зачищается до блеска. Раковины и глубокие необработанные царапины не должны остаться на детали. В противном случае атомы во время гальванизации не смогут образовать хорошей связи и выпадут в осадок. После механической обработки нужно погрузить деталь в сильный щелочной или кислотный раствор. Можно воспользоваться кратковременным изменением полярности на установке. Стальные детали опускают на несколько минут в разогретый до 90 градусов фосфорнокислый натрий. Медь или её сплавы очищают содой или любым моющим средством. Можно также применить фосфорнокислый натрий, но не подогретый.
Медь или её сплавы очищают содой или любым моющим средством. Можно также применить фосфорнокислый натрий, но не подогретый.
Блок: 5/12 | Кол-во символов: 797
Источник: https://amperof.ru/teoriya/galvanika-v-domashnix-usloviyax.html
Гальваника в домашних условиях: меднение
Почему в гальванике столь востребована именно медь? Она имеет высокую адгезию (иными словами – сцепление) к самым разным материалам. Это значит, что она превосходно держится на стальных и прочих изделиях, не отлетая и не скалываясь.
Медь – красивый яркий металл, внешне напоминает самородки розово-красного оттенка. Материал проводит не только тепло, но и электрический ток – отсюда и высокий спрос в сфере электротехники и приборостроении. Однако чистую медь найти сложно. Чаще она поставляется с различными примесями.
Медные покрытия:
- Отличаются малым сопротивлением, что используется в электротехнике
- Скрывает мелкие недочеты поверхности.
- Быстро окисляется, что используют для получения эффекта «антик».

Технологий нанесения покрытия существует две. Одна происходит путем погружения изделия в раствор электролиты (с подачей тока или без). Второй же способ – это метод селективного нанесения покрытия без погружения в раствор. Рассмотрим оба.
Метод погружения
Поверхность, подвергаемую гальванике, следует скрупулезно образом обработать. Например, наждачной бумагой и щеточкой. После обязательно обезжирьте деталь и промойте.
Дальше:
- Анодную пластину (можно две) помещают в емкость, которую будем называть ванной. На аноды замыкают положительную клемму.
- Между анодами на любом удобном проводнике подвешивается деталь, к ней подводят отрицательный полюс от блока питания.
- Готовый раствор вливается в ванночку – при этом уровень покрытия должен быть выше, чем расположена деталь.
- После подключения электродов к источнику тока выставляют рабочий ток. Это примерно 1 А/кв.дм. покрытия.
Продолжительность работы зависит от необходимой толщины слоя, обычно от 5 минут.
Покрытие без погружения
Данный способ имеет ограничения – чаще всего он подходит для реставрации поверхности. Таким способом можно нанести только небольшие толщины покрытий. Нет смысла покрывать таким методом изделия, которые можно меднить в ванне.
Порядок действий:
- Готовят «тампон» для нанесения покрытия. Берут медный проводник и наматывают кусок искусственной ткани (полиэстер подойдет).
- Противоположный конец проводника подсоединяют к положительной клемме источника напряжения.
- Электролитным раствором наполняют емкость – так удобнее окунать карандаш.
- Деталь аккуратно очищают и обезжиривают, а потом помещают в пустую ванночку. Там изделие подсоединяется к отрицательной клемме.
- Тампон смачивают в растворе. Затем им проводят по поверхности изделия, закрашивая ее постепенно.
Процесс длится до момента покрытия медным слоем изделия.
Блок: 6/8 | Кол-во символов: 2548
Источник: https://6mkm. ru/nashi-tehnologii/mednenie/mednenie-v-domashnih-usloviyah/
ru/nashi-tehnologii/mednenie/mednenie-v-domashnih-usloviyah/
Требования техники безопасности
Любая гальваническая операция (цинкование, хромирование, никелирование, меднение и др.) является опасным технологическим процессом, поэтому при ее выполнении в домашних условиях необходимо строго следовать требованиям техники безопасности. Опасной гальванику делают как токсичные химические вещества, так и высокая температура нагрева электролита, а также риски, связанные с любыми электрохимическими процессами.
Для проведения гальваники в домашних условиях лучше отвести нежилое помещение, в качестве которого может выступать гараж или мастерская. В нем обязательно должна быть организована качественная вентиляция. Все электрическое оборудование, которое вы будете использовать для того, чтобы сделать гальванику, необходимо заземлить.
Резиновые перчатки, очки и респиратор – минимум необходимых защитных средств
Личная безопасность – самое важное правило, которого следует строго придерживаться при осуществлении гальваники в домашних условиях. К мерам, которые способны обеспечить такую безопасность, следует отнести:
К мерам, которые способны обеспечить такую безопасность, следует отнести:
- использование респиратора для защиты дыхательных путей;
- защита рук при помощи мягких и прочных резиновых перчаток;
- использование при работе клеенчатого фартука и обуви, способной защитить от ожогов кожу ног;
- защита органов зрения при помощи специальных очков.
Кроме того, во время процедуры гальваники не следует ничего есть и пить, чтобы случайно не наглотаться и вредных испарений.
Чтобы быть готовым к любым неожиданностям, которые могут возникнуть в процессе выполнения такой операции, лучше предварительно почитать специальную литературу или даже посмотреть обучающее видео на данную тему.
Блок: 6/10 | Кол-во символов: 1672
Источник: http://met-all.org/obrabotka/himicheskaya/galvanika-domashnih-usloviyah-svoimi-rukami-hromirovanie-mednenie. html
html
Сравнительные показатели растворов
В процессе меднения используется большое количество специальных технологических растворов, разделяемых на две большие группы:
- Простой кислый электролит. Из простых применяется фторборатный, кремнефторидный, сульфатный, хлоридный и сульфамидный раствор.
- Комплексный электролит. Преимущественно щелочные, медь присутствует как положительно или отрицательно заряженные комплексные ионы.
График поляризационных кривых осаждения меди из различных типов электролитов
Процесс осаждения в кислых электролитах происходит при высокой плотности по току, они устойчивы, просты по химическому составу. Главными составляющими являются соответствующие кислоты и соли, осадки меди из них достаточно плотны и имеют крупнокристаллическую структуру. Недостатки – непосредственное меднение стали, цинковых сплавов и иных металлов происходит с более низким отрицательным потенциалом, чем медь.
Обработка деталей в комплексных электролитах выполняется за счет комплексных ионов, для них требуется высокая катодная поляризация. Выход по току меньше, что способствует более равномерному осаждению, структура мелкокристаллическая. Используются пирофосфатные, цианидные, аммонийные, триполифосфатные, цитратные и другие растворы.
Выход по току меньше, что способствует более равномерному осаждению, структура мелкокристаллическая. Используются пирофосфатные, цианидные, аммонийные, триполифосфатные, цитратные и другие растворы.
Способность рассеивания электролитов для меднения
Простые кислые составы
- Сульфатные. Главные компоненты серная кислота и сульфат меди. Сернокислое соединение отличается невысокой электропроводимостью, для повышения параметра добавляется серная кислота. Выход меди по току достигает 100%, на катоде не выделяется водород. За счет повышения концентрации кислоты уменьшается растворимость сульфата, что понижает верхний предел максимально допустимой плотности тока.
Влияние содержания серной кислоты на электропроводность электролита
При перемешивании увеличивается концентрация медных ионов на катодном слое. При повышении температуры возрастает растворимость сульфата меди, электролит повышает кислотность, что приводит к получению мелкокристаллических осадков.
Для улучшения катодной поляризации в электролит добавляются поверхностно активные вещества. Дополнительно они уменьшают образование наростов на острых краях.
Режимы и состав сульфатных электролитов для меднения
Для образования блестящего покрытия используются аноды АМФ, не допускающие образование шлама, или аноды из особо чистой рафинированной меди.
Влияние концентрации меди на плотность тока с перемешиванием (1) и без перемешивания (2). Электролит фторборатный.
Электролит фторборатный.
Для недопущения попадания шлама аноды помещаются в чехлы, изготовленные из кислотоустойчивого материала, дополнительно раствор постоянно фильтруется.
- Фторборатные. Отличаются высокой устойчивостью, гальваническое нанесение получается плотным и мелкокристаллическим, рассеивающие показатели такие же, как при сульфатном меднении. За счет большой растворимости увеличивается плотность тока, осаждать медь непосредственно на детали нельзя.

Состав и режим работы фторборатных электролитов
При непрерывном перемешивании допускается повышать плотность тока. Контроль технологически параметров меднения осуществляется измерением кислотности раствора. Для повышения качества меднения используется карбонат натрия, для понижения медный купорос.
- Нитратные. Электролит используется при гальванопластике, обеспечивает повышенное качество осадка.
Режимы и состав нитратных электролитов
Комплексные электролиты
- Цианидные. Условия обработки значительно отличаются от осаждения из кислых, в них медь существует в виде комплексных ионов, что заметно понижает ее активность. Увеличение плотности тока принуждает катодный потенциал резко смещаться в поле отрицательных значений. Но процесс меднения нельзя производить при увеличенной плотности тока в связи с тем, что выход меди может падать до нуля. Главными компонентами раствора являются свободный цианид натрия и комплексный цианид калия.
 Во время работы содержание меди понижается из-за недостаточной их растворимости.
Во время работы содержание меди понижается из-за недостаточной их растворимости.
Режим и состав цианидных электролитов для меднения
- Пирофосфатные. Медные осадки имеют мелкокристаллическую структуру, гладкие, блестящие или полублестящие. Для улучшения качества обработки и повышения катодной и анодной плотностей может добавляться медный купорос. Катодный потенциал в пирофосфатных растворах имеет более отрицательные параметры, чем у кислотных.
Режим и состав пирофосфатных электролитов
- Этилендиаминовые. Процесс меднения может осуществляться непосредственно по поверхности стали, при низких плотностях тока катодная поляризация достигает больших значений. Рассеивающие характеристики выше, чем у сульфатных, но ниже, чем имеет цианидный раствор.
Режим и состав этилендиаминовых электролитов
Загрузка и выгрузка деталей должна выполняться при минимальной силе тока, в первые 40–50 секунд дается толчок тока, в три раза превышающий рабочие значения меднения.
- Полиэтиленполиаминовые. Во время обработки деталей потенциалы смещаются в поле отрицательных значений, электролит применяется вместо цианидных.
Режим работы и составы полиэтиленполиаминовых электролитов
- Аммонийные. В состав входит аммиак, сульфат аммония и сульфат меди. При невысоких плотностях тока уменьшается выход по току, улучшение меднения осуществляется за счет добавления нитрата аммония. Осадки равномерные по толщине, плотные и полублестящие.
Режимы работы и состав аммонийного электролита
Без специальной обработки поверхностей медные осадки имеют недостаточную адгезию, причина – пассивирование стали раствором аммиака. Улучшение параметров покрытия достигается введением в раствор нитрата меди.
Устройство ванны медненияЛинейные параметры и конструктивные особенности должны отвечать требованиям ГОСТ 23738-85. Гальваническая ванна изготавливается из модифицированных особо устойчивых пластиков, конкретные марки подбираются с учетом параметров технологических процессов.
Ванна без кармана. Наиболее простая конструкция, применяется как в отдельности, так и на производственных линиях.
Ванна без кармана
Ванна с карманом. Обработка может выполняться с одновременными процессами удаления верхнего загрязненного слоя электролита.
Ванна с карманом
Конкретный выбор ванны меднения осуществляется в зависимости от особенностей предприятия, характеристик подлежащих меднению деталей и общих производственных мощностей.
Во время проектирования рассчитываются максимальные нагрузки с учетом объема раствора, длина, высота и ширина может изменяться по желанию заказчиков. При необходимости на ванны меднения устанавливается дополнительное оборудование и водопроводная арматура. За счет специальных механизмов улучшается качество процесса меднения. Используемые пластики адаптируются к химическому составу электролита и температурным режимам меднения.
Механическая подготовка поверхностей
Перед меднением с поверхности должна удаляться окалина, заусеницы и раковины. Качество обработки регламентируется положениями действующего ГОСТа 9.301-86. Конкретные параметры шероховатости устанавливаются в зависимости от назначения покрытия. После механической обработки деталей с поверхности должны быть удалены все дефекты, оказывающие негативное влияние на качество меднения. В обязательном порядке удаляется техническая смазка и эмульсия, металлическая стружка, продукты коррозионных процессов и пыль.
Качество обработки регламентируется положениями действующего ГОСТа 9.301-86. Конкретные параметры шероховатости устанавливаются в зависимости от назначения покрытия. После механической обработки деталей с поверхности должны быть удалены все дефекты, оказывающие негативное влияние на качество меднения. В обязательном порядке удаляется техническая смазка и эмульсия, металлическая стружка, продукты коррозионных процессов и пыль.
Подготовка к меднению производится при следующих технологических операциях:
- Шлифование. Верхний слой деталей снимается абразивными элементами, может быть тонким, декоративным или грубым.
- Полирование. Во время операции сглаживаются мельчайшие выступы, поверхность блестящая зеркальная.
- Крацевание. Для очистки поверхностей применяются металлические щетки.
- Галтовка. Детали обкатываются в специальных колоколах.
- Химическое и электрохимическое обезжиривание. Для обработки используют органические и неорганические растворы.

От качества предварительной подготовки поверхностей во многом зависит процесс меднения и физические показатели осадков.
Блок: 3/3 | Кол-во символов: 7867
Источник: https://plast-product.ru/galvanicheskoe-mednenie/
Материалы, которые чистящие химикаты не могут удалить
Частицы различных материалов или дефекты, присутствующие на подготавливаемом катоде, могут не удаляться с помощью химикатов. К ним относятся следующие позиции:
- остатки сварочного припоя и шлак;
- капли различных смол или их остаточные покрытия;
- глубокие повреждения в виде заусенцев или неровных краёв;
- слои пригоревшего жира или остатки эмалей и красок.
Недопустимо приступать к работе с изделием до полного удаления инородных вкраплений или покрытий.
Блок: 7/12 | Кол-во символов: 498
Источник: https://amperof.ru/teoriya/galvanika-v-domashnix-usloviyax.html
Гальванопластика
Процесс гальванопластики
Покрытие медью может быть выполнено не только на металлических предметах. Широко распространена гальванопластика, когда меднение выполняется по различным засушенным растениям, насекомым и прочим неметаллическим предметам.
Широко распространена гальванопластика, когда меднение выполняется по различным засушенным растениям, насекомым и прочим неметаллическим предметам.
Технология нанесения покрытия мало отличается от обычной, только вначале процесса на поверхность надо нанести электропроводный лак. После засыхания лакового покрытия производятся обычные действия по нанесению слоя меди. Полученные изделия обладают высокими декоративными или художественными качествами и высоко оцениваются зрителями.
Видео по теме: Как сделать меднение своими руками в домашних условиях
Блок: 7/7 | Кол-во символов: 668
Источник: https://VtorExpo. ru/galvanika/tehnologiya-medneniya-v-domashnih-usloviyah.html
ru/galvanika/tehnologiya-medneniya-v-domashnih-usloviyah.html
Меднение
Меднение с использованием гальваники в домашних условиях необходимо для того, чтобы создать на поверхности обрабатываемого изделия токопроводящий слой, отличающийся небольшим значением электрического сопротивления, а также для того чтобы защитить деталь от негативного воздействия внешней среды.
Наносить слой меди на стальные и чугунные изделия, предварительно не покрыв их слоем никеля, смертельно опасно, так как для этого необходимо использовать цианистый электролит.
После предварительного никелирования металл покрывают слоем меди с использованием раствора сернокислой меди, концентрированной серной кислоты и воды комнатной температуры.
Блок: 9/10 | Кол-во символов: 670
Источник: http://met-all.org/obrabotka/himicheskaya/galvanika-domashnih-usloviyah-svoimi-rukami-hromirovanie-mednenie. html
html
Работа с раствором металлического ионного электролита
При гальванизации дома мастеру нужно заранее предопределить, какой химической реакции необходимо добиться. От этого зависят материал, используемый для анода, и состав электролитного раствора. Атомы, которые будут присоединяться к заготовке, должны входить в состав электролита. Следовательно, для получения золотого или серебряного покрытия электролит должен иметь золотую или серебряную основу. В случае покрытий благородными металлами в качестве анода может выступать свинец, но электролит должен периодически обновляться.
Блок: 9/12 | Кол-во символов: 577
Источник: https://amperof.ru/teoriya/galvanika-v-domashnix-usloviyax.html
Видео
Блок: 12/12 | Кол-во символов: 5
Источник: https://amperof. ru/teoriya/galvanika-v-domashnix-usloviyax.html
ru/teoriya/galvanika-v-domashnix-usloviyax.html
Количество использованных доноров: 8
Информация по каждому донору:
- https://WikiMetall.ru/metalloobrabotka/mednenie-v-domashnih-usloviya.html: использовано 2 блоков из 6, кол-во символов 2521 (8%)
- http://met-all.org/obrabotka/himicheskaya/galvanika-domashnih-usloviyah-svoimi-rukami-hromirovanie-mednenie.html: использовано 3 блоков из 10, кол-во символов 3633 (12%)
- https://tokar.guru/samodelkin/mednenie-galvanikoy-i-galvanoplastika-v-domashnih-usloviyah.html: использовано 1 блоков из 7, кол-во символов 4745 (15%)
- https://6mkm.ru/nashi-tehnologii/mednenie/mednenie-v-domashnih-usloviyah/: использовано 3 блоков из 8, кол-во символов 5199 (17%)
- https://amperof.ru/teoriya/galvanika-v-domashnix-usloviyax.html: использовано 4 блоков из 12, кол-во символов 1877 (6%)
- https://VtorExpo.ru/galvanika/tehnologiya-medneniya-v-domashnih-usloviyah.
 html: использовано 2 блоков из 7, кол-во символов 1473 (5%)
html: использовано 2 блоков из 7, кол-во символов 1473 (5%) - https://plast-product.ru/galvanicheskoe-mednenie/: использовано 3 блоков из 3, кол-во символов 9884 (31%)
- http://BoldProject.ru/raznoe/mednenie-v-domashnix-usloviyax.html: использовано 2 блоков из 4, кол-во символов 2087 (7%)
Меднение алюминия медным купоросом в домашних условиях. Простой электролит для меднения металла в домашних условиях
В этом интересном видео-уроке рассмотрим, как можно сделать раствор, который будет выполнять функции электролита для омеднения любых предметов из металла, например, алюминия с помощью туалетного утенка.
Что нужно для процесса.
Для этого нам понадобится пластиковая бутылка с водой, медный провод без изоляции. Желательно, брать проволоку минимального сечения, чтобы площадь реакции была максимально большой. Если нет медной проволоки, подойдут монетки, в состав которых входит медь не желтого цвета. Вместо провода или монеток можно использовать абсолютно любую медную стружку, обрезки, отходы, в которые входит медь. Также нужно добавить небольшой кусочек олова.
Также нужно добавить небольшой кусочек олова.
В качестве предмета для омеднения в данном видеоуроке будет выступать стальная рукоятка ножа. Кроме туалетного утенка может подойти и другое чистящее средство, в состав которого входит соляная кислота, которая входит в реакцию с медью и растворяет ее.
Приготовим состав раствора для меднения.
Итак для начала сделаем следующее. Содержимое туалетного утенка необходимо влить в бутылочку с водой, чтобы получить раствор, в который будет погружена медь. Теперь в раствор кладем медный провод и кусочек олова. После этого этот раствор необходимо оставить, желательно, в теплом месте на как можно более долгий срок. Концентрация соляной кислоты, которая содержится в утерке, требует держать баночку для растворения меди в течение одного месяца. Вот и весь состав раствора.
Обработка заготовки для покрытия медью.
Желательно металлическую заготовку очистить от ржавчины и грязи кипячением в растворе щёлочи или, на худой конец, обычный шкуркой.
Когда очистка и шлифовка закончена, необходимо заготовку обезжирить, так как пальцы рук человека содержат жир.
Перед использованием раствора для омеднения, его нужно хорошо встряхнуть, чтобы соли меди смешались с жидкостью. Теперь можно поместить заготовку в меднящий раствор. Желательно во время омеднения емкость с электролитом иногда покачивать, и переворачивать заготовку, чтобы создать приток свежего раствора к ней.
Прошло уже полтора часа, можно посмотреть, как прошел процесс. Хорошо видно, что заготовка покрылась медью. Ее нужно обязательно промыть водой. Медь на ней держится очень хорошо. Очень красиво получилось, но лучше не покрывать рукоять ножа медью, так как она имеет свойство окисляться и пачкать, соответственно, руку. можно сделать и не только это.
Процесс извлечения металла из раствора и нанесения его на поверхность металлическго изделия называется гальваностегией. Меднение — нанесение меди на поверхность металлического изделия.
Процесс меднения распространен в промышленности, и используется не только как самостоятельный процесс, но и как подготовительный процесс перед хромированием, никелированием и серебрением. Применение меднения, как подготовительной операции, связано с тем, что медь очень прочно держится на стали, выравнивает дефекты поверхности и другие металлы очень хорошо осаждаются на медь, а чистую сталь — плохо.
Применение меднения, как подготовительной операции, связано с тем, что медь очень прочно держится на стали, выравнивает дефекты поверхности и другие металлы очень хорошо осаждаются на медь, а чистую сталь — плохо.
Меднение металлов в домашних условиях не такая сложная операция, есть два способа: с погружением в электролит и без.
Меднение металла с погружением в электролит.
Металлический предмет обработайте, как обычно,
наждачной бумагой, чтобы удалить оксидную пленку, протрите щеткой, как
следует промойте водой, обезжирьте в горячем содовом растворе и промойте
еще раз. В банку или стакан опустите на проволочках (лучше медных) две
медные пластинки — аноды. Между ними на проволочке же подвесьте деталь. Те проволочки, которые идут от медных
пластинок, соедините вместе и подключите к положительному полюсу источника
тока, а деталь — к отрицательному; включите в цепь реостат, чтобы регулировать ток, и миллиамперметр
(тестер). Источник постоянного тока с напряжением не более 6 В.
Раствор электролита для меднения: 20 г медного купороса и 2-3 мл серной кислоты на 100 мл воды — налейте в емкость, раствор должен полностью покрыть электроды. Пользуясь реостатом, установите ток от 10 до 15 мА на каждый квадратный сантиметр поверхности детали. Минут через двадцать выключите ток и выньте деталь — она покрыта тонким слоем меди. Чем дольше идет процесс, тем толще слой меди.
Меднение без погружения в электролит.
Этот процесс подходит не только для стали, но и для цинка и алюминия. С одного конца мягкого многожильного провода снимите изоляцию и растеребите тонкие медные проволочки, чтобы получилась медная кисть. Для удобства работы привяжите ее к деревянной палочке или карандашу, а другой конец провода подсоедините к положительному полюсу источника тока.
Приготовьте электролит — концентрированный раствор медного купороса, желательно слегка подкисленный, — и налейте в широкую склянку, в которую удобно будет макать «кисть».
Подготовьте металлическию пластинку или другой небольшой предмет, желательно с плоской поверхностью.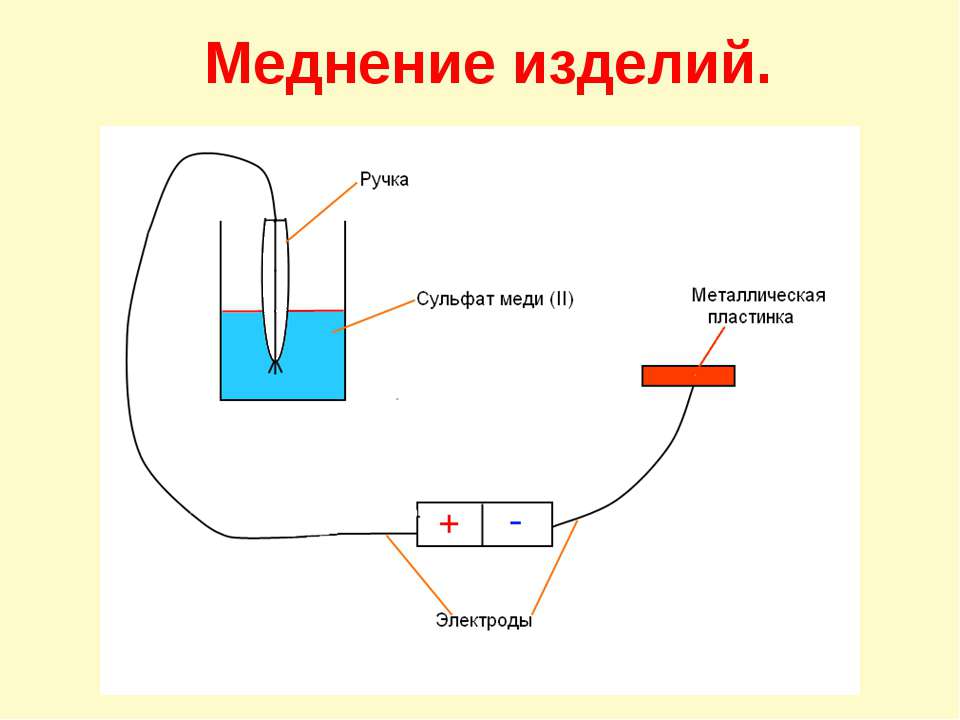 Протрите его мелкой наждачной шкуркой и обезжирьте, прокипятив в растворе стиральной соды. Положите пластинку в ванночку или кювету и подсоедините ее проводом к отрицательному полюсу источника тока. Схема собрана, осталось только ввести электролит.
Протрите его мелкой наждачной шкуркой и обезжирьте, прокипятив в растворе стиральной соды. Положите пластинку в ванночку или кювету и подсоедините ее проводом к отрицательному полюсу источника тока. Схема собрана, осталось только ввести электролит.
Обмакните «кисть» в раствор медного купороса и проведите ею вдоль пластинки, стараясь не дотрагиваться до поверхности; работайте так, чтобы между пластинкой и кистью был всегда слой электролита. Проводки все время должны быть смочены раствором. На глазах пластинка будет покрываться красным слоем металлической меди. На обработку маленькой детали уйдут считанные минуты. Когда покрытие нанесено, высушите деталь на воздухе и матовый слой меди натрите до блеска шерстяной или суконной тряпкой.
Такой процесс, при котором деталь не опускают в электролитическую ванну, а обрабатывают снаружи небольшими участками, добавляя все время электролит, используют в тех случаях, когда деталь настолько велика, что для нее не подберешь подходящей ванны.
Гальваника представляет собой раздел электрохимической науки, которая изучает осаждение некоторых элементов на любую поверхность. С помощью гальваники в домашних условиях или в промышленности можно нанести на изделие тонкий слой металла, который будет выступать в роли защитного слоя или выполнять декоративные функции. В последнее время декоративное покрытие набирает популярность у тех, кто хочет сделать оригинальный подарок своим друзьям и родным.
Общие сведения
Покрытие гальваникой бывает технологическим или декоративно-защитным. Это тонкий металлический тонкий слой, который в зависимости от гальванических элементов может выполнять эстетические функции. Гальванопластика не увеличивает прочность изделия, поскольку в этом случае требуются большие производственные мощности, но для красоты и придания «свежести» вполне подойдет.
Гальванические реакции происходят с помощью постоянного электрического тока. В специальную емкость-диэлектрик наливают раствор — электролит, в который погружают два анода. Аноды должны быть изготовлены из металла, который будет осаждаться на покрываемом изделии.
Аноды должны быть изготовлены из металла, который будет осаждаться на покрываемом изделии.
Обрабатываемая деталь присоединяется к минусовому выводу и помещается между анодами. Она выполняет роль катода. Аноды, в свою очередь, присоединяются к плюсовому контакту источника питания. Они становятся частью цепи, проводя ток в электролит и отдавая ему свои металлические элементы. Электролит передает необходимые частицы обрабатываемой детали, они постепенно обволакивают её тонким слоем. Аноды по площади должны превышать в несколько раз размер заготовки.
Другими словами, гальванизация представляет собой перенос молекул металла раствора на изделие в момент протекания через них электротока.
Любой гальванический процесс можно разбить на общие этапы:
- Сборка гальванической установки.
- Подготовка электролитного раствора.
- Обработка и подготовка образца.
- Запуск гальванического процесса.
Оборудование можно подготовить самостоятельно. Сначала подбирается подходящий источник питания. Это может быть батарейка (для обработки изделий небольшого размера) или аккумулятор. Подойдет понижающий блок питания, который выдает на выходе постоянный ток до 12 вольт. Иногда используют инвертор от сварочного аппарата. Подбирается реостат для регулирования силы тока.
Сначала подбирается подходящий источник питания. Это может быть батарейка (для обработки изделий небольшого размера) или аккумулятор. Подойдет понижающий блок питания, который выдает на выходе постоянный ток до 12 вольт. Иногда используют инвертор от сварочного аппарата. Подбирается реостат для регулирования силы тока.
Из нейтрального, устойчивого к химически агрессивным веществам материала подбирается широкая и глубокая ванночка. Надо учитывать, что электролитический раствор при гальваническом процессе может нагреваться до девяноста градусов по Цельсию.
Подготавливаются две пластины, которые будут токопроводящими анодами.
Для нагрева ёмкости с электролитом нужен электрический прибор с возможностью плавной регулировки температурного режима. Чаще всего используют подошву утюга или небольшую электроплитку. С их помощью происходит нагрев раствора до необходимой температуры и ускорение реакции.
Химические реактивы необходимо хранить в плотно закупоренной стеклянной посуде. Желательно каждый предмет подписывать.
Желательно каждый предмет подписывать.
Потребуются весы для точного измерения массы веществ, поскольку необходимая точность веса компонентов составляет один грамм. Такие весы можно приобрести, а можно сделать самостоятельно, используя вместо гирек старые советские монеты. Вес «желтых» монет точно соответствует их номиналу.
После того как собраны необходимые вещества, найдены ёмкости, собрана электрическая схема с питанием и подготовлена система подогрева, можно заняться чисткой заготовки.
Если недостаточно хорошо почистить деталь, гальваническое покрытие непрочно осядет или будет неравномерным. Иногда хватает простого обезжиривания предмета. Раствор ацетона или спирта может хорошо обезжирить поверхность, можно использовать бензин.
Некоторые мастера держат изделия из стали в разогретом до 90 градусов по Цельсию растворе фосфорнокислого натрия. Цветные металлы можно очищать в том же растворе, не нагревая его.
Если на изделии есть коррозия или другие изъяны, то поверхность заготовки шлифуется наждачной бумагой.
Иногда про технику безопасности при различных работах в домашних условиях рассказывают вскользь. Но при выполнении любых гальванических работ нужно строго соблюдать безопасность.
Опасность заключается в использовании токсичных химических веществ, высокой температуре нагрева раствора и повышенными рисками, которые сопровождают электрохимические реакции.
Лучше всего гальванические работы проводить в гараже или мастерской при обязательном проветривании или вентилировании помещения. Особое внимание следует уделить заземлению оборудования. Нужно соблюдать меры личной безопасности, а именно:
- Дыхательные пути следует защитить респиратором.
- Руки и запястья должны быть спрятаны в высокие и прочные резиновые перчатки.
- Обувь должна защищать от ожогов, а одежда прикрыта клеенчатым фартуком.
- Обязательно ношение специальных защитных очков.
Перед началом работ по меднению в домашних условиях нужно подготовить необходимые материалы и оборудование. Надо позаботится об источнике напряжения и постоянного тока. Существует много рекомендаций касательно силы тока, разброс которого может быть большим. Поэтому желательно иметь реостат с возможностью плавной регулировки напряжения и для постепенного завершения процесса. Источником может служить автомобильный аккумулятор или выпрямитель с напряжением на выходе не больше 12 вольт. Для первых опытов будет достаточно обычной батарейки от 4.5 до 9 вольт.
Надо позаботится об источнике напряжения и постоянного тока. Существует много рекомендаций касательно силы тока, разброс которого может быть большим. Поэтому желательно иметь реостат с возможностью плавной регулировки напряжения и для постепенного завершения процесса. Источником может служить автомобильный аккумулятор или выпрямитель с напряжением на выходе не больше 12 вольт. Для первых опытов будет достаточно обычной батарейки от 4.5 до 9 вольт.
Затем выбирается ёмкость для электролитического раствора, лучше всего из жаропрочного стекла. В любом случае все ёмкости для электролиза должны быть диэлектриками и выдерживать температуру не менее, чем 80 градусов по Цельсию.
В качестве анодов подойдут два больших медных листа. Они должны перекрывать по размеру заготовку. Из химических реактивов потребуются:
- Купорос медный.
- Кислота соляная либо серная.
- Вода дистиллированная.
Меднение в домашних условиях пользуется заслуженной популярностью, поскольку очень хорошо и надежно держится на стальных изделиях. Главное условие — правильно соблюдать технологию процесса.
Главное условие — правильно соблюдать технологию процесса.
Имеется два способа нанесения меди на поверхность:
- Помещение заготовки в раствор электролита.
- Неконтактный способ. В этом случае изделие не погружается в раствор.
Подготавливается и обрабатывается поверхность изделия при помощи тонкого наждака и щеточки. После этого деталь моется в проточной воде, обезжиривается и еще раз промывается.
Этапы процесса омеднения следующие:
- Два медных анода подключают в сеть к положительным контактам и размещают их в стеклянную банку.
- К обработанному изделию подводят контакт с отрицательным значением напряжения и свободно подвешивают между анодами.
- Подключают реостат согласно электрической схеме для возможности регулирования силы тока.
- Подготавливается раствор в правильных пропорциях. На 100 г дистиллированной воды надо 20 г медного купороса и 2−3 г соляной кислоты. Вместо соляной кислоты можно использовать другую.

- Раствор выливается в посуду с медными пластинами и деталью таким образом, чтобы они полностью скрылись под поверхностью раствора.
- Подключается источник напряжения. Реостатом добиваются необходимой силы тока из примерного расчета 10−15 миллиампер на каждый квадратный сантиметр площади детали.
Весь процесс занимает примерно 15−20 минут. После обязательного выключения источника питания и остывания раствора готовое изделие с медным слоем на поверхности вынимается из банки.
Этот метод интересен тем, что его можно использовать для обработки не только стальных предметов, но и сделанных из других материалов. Например, алюминия и цинка. Порядок процесса следующий:
- Из многожильного медного провода изготавливается «кисточка». Конец провода оголяется. Из медных проводков создается подобие кисточки, чтобы затем прикрепить ее к деревянной ручке-держателю.
- Второй конец провода подключается к плюсовому контакту электрической цепи.

- В широкую ёмкость заливается стандартный электролитный раствор из медного купороса и соляной кислоты.
- Предварительно очищенная и промытая металлическая заготовка присоединяется к отрицательному контакту и размещается в пустой ёмкости.
- Импровизированная кисточка окунается в раствор электролита и проводится по поверхности заготовки без контакта. Это действие повторяется до получения результата.
Когда деталь полностью покроется слоем меди, выключается блок питания и процесс завершается. Деталь ополаскивается в воде и просушивается.
Часто с помощью медного электролиза обновляют столовые приборы, сделанные из алюминия. Если нет опыта проведения этого процесса, то можно потренироваться нанести медь на алюминиевые пластинки. Порядок проведения процесса:
Гальванопластика — это электрохимический способ придания предмету определенной формы с помощью осаждения на него металла. Чаще всего этот метод используют при обработке металлом неметаллических предметов или при изготовлении копий ювелирных изделий.
Если при гальванопластике изделие не обладает электропроводящими свойствами, то его предварительно покрывают графитом, иногда бронзой. Затем мастер делает с копии слепок и начинает гальванический процесс. В качестве материала слепка используют гипс, графит или легко плавящийся металл.
Гальваника — это очень интересный и познавательный процесс, но он связан с активными веществами, которые могут навредить здоровью и нанести вред имуществу или окружающей среде. Поэтому перед тем как начинать гальванику своими руками, нужно принять все меры безопасности, изучить немного теории процесса и особенности поведения химических реактивов.
Медь — это один из древних металлов: люди начали применять ее для создания орудий труда еще в 4 тысячелетии до нашей эры. Такое широкое распространение меди объяснимо тем, что вещество встречается в природе в металлическом самородном состоянии. И сегодня медь используется повсеместно — в металлургии, автомобильной промышленности, электротехнике и строительстве.
Состав меди
Металлическая медь представляет собой тяжелый металл розово-красного цвета, ковкий и мягкий, который плавится при температуре больше 1080 градусов по Цельсию, очень хорошо проводит теплоту и электрический ток: электропроводимость меди выше в 1,7 раза, чем алюминия и больше в 6 раз выше, чем железа, и только немного уступает электропроводимости серебра.
Специфические особенности меди определяются содержанием в металле конкретных примесей, количество которых может различаться приблизительно в 10 — 50 раз. По содержанию кислорода принято использовать следующую классификацию меди:
- бескислородная медь с содержанием кислорода меньше 0,001%;
- медь рафинированная с содержанием кислорода от 0,001до 0,01%, но с увеличенным присутствием фосфора;
- медь большой чистоты с содержанием кислорода примерно 0,03-0,05%;
- металл общего назначения с содержанием кислорода 0,05 — 0,08%.
В меди кроме кислорода может присутствовать водород, который в металл попадает в процессе электролиза или при совершении отжига в атмосфере, которая содержит водяной пар. При высокой температуре водяной пар разлагается с формированием водорода, который в медь легко диффундирует.
При высокой температуре водяной пар разлагается с формированием водорода, который в медь легко диффундирует.
Атомы водорода в бескислородной меди размещаются в междоузлиях кристаллической решетки и на свойствах металла особо не сказываются. В кислородсодержащей меди водород способен взаимодействовать при высоких температурах с закисью меди, при этом образуется в толще меди водяной пар, которому присуще высокое давление, что приводит к вздутиям, трещинам и разрывам. Это явление носит название «водородная болезнь».
Железо, висмут, сурьма и свинец ухудшают пластичность меди. Примеси, что являются малорастворимыми в меди (свинец, кислород, сера, висмут), провоцируют хрупкость при высокой температуре, что затрудняет процесс горячей обработки давлением.
Физические свойства меди
Основное свойство меди, определяемое её использование, — высокая электропроводность или малое удельное электрическое сопротивление. Подобные примеси как железо, фосфор, мышьяк, олово и сурьма, значительно ухудшают её электрическую проводность. На величину электропроводности оказывает большое влияние механическое состояние меди.
На величину электропроводности оказывает большое влияние механическое состояние меди.
Второе важное свойство меди — значительная теплопроводность. Легирующие добавки и свойства уменьшают теплопроводность меди, поэтому созданные на медной основе сплавы самой меди значительно уступают по этому показателю.
Медь при нормальных температурах является коррозиционно устойчивой в таких средах, как пресная вода, сухой воздух, морская вода при небольшой скорости движения воды, неокислительные кислоты и растворы соли при отсутствии кислорода, сухие галогенные газы, щелочные растворы за исключением солей аммония и аммиака, органические кислоты, фенольные смолы и спирты.
В аммиаке, хлористом аммонию, окислительных минеральных кислотах и растворах кислых солей медь не устойчива. Её коррозионные свойства также заметно ухудшаются в некоторых средах с возрастанием количества примесей. Допускается контакт меди с её сплавами, с оловом, свинцом во влажной атмосфере, морской и пресной воде. В то же время контакт меди с цинком и алюминием не допускается вследствие их быстрого разрушения.
В то же время контакт меди с цинком и алюминием не допускается вследствие их быстрого разрушения.
Медь, ее сплавы и соединения нашли широкое применение в разных отраслях промышленности. Медь в электротехнике используют в чистом виде в производстве шин контактного и голого проводов, кабельных изделий, электрогенераторов, телефонного оборудования и радиоаппаратуры. Из меди изготавливают вакуум-аппараты, теплообменники и трубопроводы.
Сплавы меди с различными металлами используют в автомобильной промышленности и для изготовления химических аппаратов. Проволока из красной меди изготовления всевозможных шнуров и выгибания самых сложных элементов. Высокие свойства меди делают ее незаменимой при производстве филигранных деталей.
Процедура меднения
Меднением называют процедуру гальванического нанесения меди, толщина слоя которой составляет 1 — 300 мкм и больше. Меднение стали является одним из важнейших процессов в гальванике, что применяется в качестве предварительного процесса при подготовке металлической поверхности для покрытия другими металлами — при хромировании, никелировании и покрытии серебром, а также как законченный самостоятельный процесс.
Использование меднения как подготовительной манипуляции связано с тем, что этот металл способен очень прочно держатся на стали, выравнивать дефекты поверхности. Другие материалы на медь хорошо осаждаются, а вот на чистую сталь — не очень.
Медные покрытия характеризуются высоким сцеплением с разными металлами, высокой электропроводностью и пластичностью. Их принято наносить на стальные, цинковые и алюминиевые детали.
Только что нанесённое покрытие меди имеет ярко-розовый матовый или блестящий цвет, зависимо от технологии нанесения. Медные покрытия в атмосферных условиях способны легко окисляться и покрываться налетом окислов, приобретая пятна различных оттенков и радужные разводы.
Использование меднения
В большинстве своем гальваническое меднение металлов используют в таких случаях:
- В декоративных целях. Огромной популярностью в настоящее время пользуются старинные изделия из меди. Процедура меднения позволяет наносить на металл медные покрытия, которые как бы «состариваются» после специальной обработки и выглядят так, будто изготовлены давным-давно.

- В гальванопластике. Используется гальваническое меднение железа для создания металлических копий изделий разной формы и различных размеров. Создаётся пластиковая или восковая основа, которую покрывают электропроводящим лаком и слоем меди. Подобную технологию меднения часто используют при изготовлении ювелирных изделий, сувениров, барельефов, матриц и волноводов.
- В технических целях. Меднение металла большое значение имеет в электротехнической области. Благодаря низкой стоимости меднения по сравнению с покрытиями золотом или серебром, медные покрытия нашли применение при изготовлении электротехнических шин, электродов, контактов и прочих элементов, которые работают под напряжением. Меднение зачастую используется как покрытие под пайку.
Меднение применяется в сочетании с прочими гальваническими покрытиями:
- При нанесении многослойного защитно-декоративного покрытия. Как правило, медь используется в сочетании с хромом и никелем (3-слойное защитно-декоративное покрытие) и прочими металлами как промежуточный слой для увеличения сцепления с основным металлом и получения более прочного и блестящего покрытия.

- Для предохранения участка при цементации. Меднение свинца способно предохранять участки стальных изделий от цементации — науглероживания. Покрывают медью исключительно те участки, которые подлежат в будущем обработке резанием. Твёрдый науглероженный поверхностный слой не поддается подобным обработкам, а медь может защитить покрытые участки от процесса диффузии углерода в них.
- При восстановлении и ремонте деталей. Меднение металла является важной процедурой при работах реставрационного характера и восстановлении хромированных частей мотто- и автомобильной техники. Наносить принято значительный слой меди — порядка 100-250 мкм и больше, который закрывает дефекты металла и поры и выполняет функции новой основы для последующих покрытий.
Виды меднения
Процедура меднения своими руками доступна для выполнения даже новичками. Для этого достаточно только знать её основные тонкости. Существует два способа меднения в домашних условиях: с погружением в электролит и без погружения.
С погружением в электролит
Металлическое изделие обрабатывают наждачной бумагой для удаления оксидной пленки, протирают щеткой, промывают как следует водой, обезжиривают в горячем содовом растворе и промывают еще один раз. После этого принято опускать в стакан или банку на медных проволочках две медные пластинки, которые являются анодами.
Между пластинками подвешивают на проволочке деталь. Проволочки, идущие от медных пластинок, соединяют вместе и подключают к плюсу источника тока, а деталь — к минусу. После этого в цепь включается реостат для регулировки тока и миллиамперметр. Необходим источник постоянного тока, который имеет напряжение не больше 6 В.
Для меднения дома нужно приготовить следующий раствор электролита. Возьмите 20 грамм медного купороса и 2-3 миллилитра серной кислоты на 100 миллилитров воды и налейте в посуду. Следите, чтобы данный раствор полностью покрыл электроды.
При использовании реостата нужно установить ток в пределах 10 — 15 мА на каждый сантиметр квадратный поверхности детали. Где-то через 20 минут следует выключить ток и вынуть изделие, оно уже покрылось тонким медным слоем. Чем дольше будет идти процесс, тем слой меди получится толще.
Где-то через 20 минут следует выключить ток и вынуть изделие, оно уже покрылось тонким медным слоем. Чем дольше будет идти процесс, тем слой меди получится толще.
Без погружения в электролит
Данную процедуру проводят для стали, алюминия и цинка. С одного конца многожильного провода снимают изоляцию, затем необходимо растеребить тонкие медные проволочки для получения медной кисти. Для удобства работы необходимо привязать ее к медной кисти или деревянной палочке, а другой конец кабеля нужно подсоединить к плюсу источника тока.
Дальше следует приготовить электролит — раствор медного купороса, лучше слегка подкисленный, и налить в широкую склянку, в которую кисть будет удобно макать. Подготовьте металлическую пластинку или какой-то другой маленький предмет с плоской поверхностью. Его нужно протереть с помощью мелкой наждачной шкурки и обезжирить посредством кипячения в растворе стиральной соды.
Затем необходимо положить пластинку в кювету или ванночку и подсоединить ее с помощью провода к минусу источника тока. После того, как схема собрана, вам следует только ввести электролит. Обмакните в раствор медного купороса «кисть», которой следует провести вдоль пластинки, не дотрагиваться до поверхности.
После того, как схема собрана, вам следует только ввести электролит. Обмакните в раствор медного купороса «кисть», которой следует провести вдоль пластинки, не дотрагиваться до поверхности.
Рекомендуется работать так, чтобы между кистью и пластинкой всегда располагался слой электролита. Все время работы проводки должны быть смоченными раствором. Пластинка на глазах будет покрываться слоем металлической меди красного цвета. Для обработки маленькой детали понадобятся считанные минуты.
Когда вы нанесли покрытие, нужно высушить на воздухе деталь и натереть матовый слой меди до блеска с помощью суконной или шерстяной тряпки. Процесс меднения алюминия, когда изделие в электролитическую ванну не опускают, а обрабатывают небольшими участками снаружи, добавляя электролит, применяют в таких случаях, когда изделие настолько велико, что для него нельзя подобрать подходящую ванны.
Ванны меднения
Установки для меднения от обыкновенных гальванических ванн ничем не отличаются. Электролиты для меднения довольно просто получить, если иметь под рукой необходимые ингредиенты. Бывают два вида медных растворов: щелочные и кислые.
Электролиты для меднения довольно просто получить, если иметь под рукой необходимые ингредиенты. Бывают два вида медных растворов: щелочные и кислые.
В кислых растворах вы не сможете получить хорошо сцепленные покрытия из меди на цинковых и стальных изделиях, потому что цинк и железо в этом случае растворяются с медью, и нарушается сцепление с защитным покрытием.
Для устранения данной особенности рекомендуется первый тонкий медный слой (2—3 мкм) создать в щелочном растворе для меднения, а в будущем наращивать покрытие до заданной толщины в кислом электролите, который является более экономичным. Цинковые изделия, что имеют сложную форму, лучше всего меднить в щелочных электролитах.
Самыми распространенными кислыми электролитами являются борфтористоводородные и сернокислые. Наибольшее использование нашли сернокислые электролиты, которые отличаются простотой состава, высоким выходом по току и значительной устойчивостью.
Перед меднением деталей из стали в кислых электролитах их рекомендуется предварительно меднить в цианистом электролите или осаждать тонкий подслой никеля. Данные электролиты имеют несколько недостатков.
Данные электролиты имеют несколько недостатков.
Один из них состоит в невозможности непосредственного покрытия цинковых и стальных деталей из-за контактного выделения меди, которая имеет плохое сцепление с металлом основы. Также электролиты незначительную рассеивающую способность и более грубую структуру осадков по сравнению с прочими электролитами.
Среди щелочных электролитов меднения известны пирофосфатные и цианистые электролиты.
Цианистые электролиты из меди характеризуются высокими рассеивающими способностями, возможностью проведения меднения столярных изделий и мелкокристаллической структурой осадков.
К недостаткам щелочных электролитов относят низкую плотность тока и неустойчивость раствора вследствие карбонизации под действием двуокиси углерода свободного цианида. Помимо этого, цианистые электролиты отличаются уменьшенным выходом по току — не больше 60-70%.
Таким образом, медь является металлом, который используется повсеместно: в автомобильной промышленности, электротехнике и строительстве. А в гальванопластике известна технология меднения для подготовки металлической поверхности под покрытие другими металлами или как самостоятельный процесс.
А в гальванопластике известна технология меднения для подготовки металлической поверхности под покрытие другими металлами или как самостоятельный процесс.
Медные покрытия, как правило, не применяются в качестве самостоятельного покрытия ни для декоративных целей, ни для защиты стальных деталей от коррозии. Это связано с тем, что медь в атмосферных условиях легко окисляется, покрываясь налетом окислов.
Однако благодаря хорошему сцеплению осажденной меди с различными металлами медное покрытие применяется в многослойных защитно-декоративных покрытиях в качестве промежуточного подслоя, а также для защиты стальных деталей от цементации. В гальванопластике медные осадки применяются для изготовления металлических копий, барельефов, волноводов и матриц.
Электролиты меднения подразделяют на кислые и щелочные. Из кислых электролитов используют сернокислые и борфтористоводородные. Наибольшее применение нашли сернокислые электролиты, отличающиеся простотой состава, устойчивостью и высоким выходом по току (до 100%). Недостатком этих электролитов является невозможность непосредственного покрытия стальных и цинковых деталей вследствие контактного выделения меди, имеющей плохое сцепление с основным металлом. Поэтому перед меднением стальных детален в кислых электролитах их предварительно меднят в цианистых электролитах или осаждают тонкий подслой никеля. К недостаткам сернокислых электролитов относятся также их незначительная рассеивающая способность и более грубая: структура осадков по сравнению с другими электролитами.
Недостатком этих электролитов является невозможность непосредственного покрытия стальных и цинковых деталей вследствие контактного выделения меди, имеющей плохое сцепление с основным металлом. Поэтому перед меднением стальных детален в кислых электролитах их предварительно меднят в цианистых электролитах или осаждают тонкий подслой никеля. К недостаткам сернокислых электролитов относятся также их незначительная рассеивающая способность и более грубая: структура осадков по сравнению с другими электролитами.
К щелочным электролитам меднения относятся цианистые, пирофосфатные и другие электролиты. Цианистые медные электролиты обладают высокой рассеивающей способностью, мелкокристаллической структурой осадков, возможностью непосредственного меднения стольных деталей. К недостаткам относятся низкая плотность тока и неустойчивость состава вследствие карбонизации свободного цианида под действием двуокиси углерода воздуха. Кроме того, цианистые электролиты характеризуются пониженным выходом по току (не более 60-70%).
Будьте внимательны! Компания «ЛВ-Инжиниринг» не предоставляет услуги по нанесению гальванических покрытий! Наша организация осуществляет проектирование гальванических производств, изготовление гальванических ванн и линий из полипропилена, монтаж и пусконаладочные работы по данному направлению.
Кислые электролиты меднения
Медь сернокислая — 150-250 г/л
Никель хлористый — 50-70 г/л
Температура = 18-25°С
Плотность тока = 1-4 А/дм 2
При перемешивании электролита сжатым воздухом можно довести катодную плотность тока до 6-8 А/дм 2 .
Для приготовления сернокислого электролита меднения растворяют медный купорос, фильтруют его в рабочую панну и при непрерывном помешивании добавляют серную кислоту.
При нанесении медных покрытий из сернокислого электролита медные аноды растворяются в основном с образованием двухвалентных ионов, которые, разряжаясь на катоде, осаждаются в виде металлической меди. Однако наряду с этими процессами происходят п другие, нарушающие нормальное течение электролиза. Возможно также анодное растворение с образованием одновалентных ионов, хотя и в меньшей степени.
Возможно также анодное растворение с образованием одновалентных ионов, хотя и в меньшей степени.
В электролите, омывающем металлическую медь, идет также химический обратимый процесс: Cu + Cu 2+ = 2Cu + .
Накопление в растворе ионов одновалентной меди в больших количествах приводит к сдвигу реакции влево, в результате чего выпадает металлическая губчатая медь.
В растворе, кроме того, происходит окисление сернокислой одновалентной меди за счет кислорода воздуха н серной кислоты, особенно при воздушном перемешивании: Cu 2 SO 4 + 1/2O 2 + H 2 SO 4 = 2CuSO 4 + H 2 O. На катоде процесс заключается в разряде двухвалентных и одновалентных ионов меди, но в связи с тем, что концентрация ионов одновалентной меди приблизительно в 1000 раз меньше концентрации ионов двухвалентной меди, катодный процесс выглядит так: Cu 2+ + 2е — = Cu. Выход по току составляет 100%.
Для получения плотного гладкого осадка в электролите необходимо присутствие сорной кислоты. Серная кислота выполняет ряд функций: значительно повышает электропроводность электролита; понижает активность ионов меди, что способствует образованию мелкозернистых осадков; предотвращает гидролиз сернокислой закисной меди, который сопровождается образованием рыхлого осадка закиси меди.
Дефекты при эксплуатации сернокислого электролита меднения и способы их устранения
| Дефект | Причина дефекта | Способ устранения |
| Грубая крупнокристаллическая структура осадков | Недостаток кислоты | Добавить кислоту |
| Высокая плотность тока | Снизить плотность тока | |
| Шероховатые осадки | Загрязнение электролита механическими примесями | Отфильтровать электролит |
| Черные и коричневые полосы на покрытии | Присутствие в электролите примесей тяжелых металлов, мышьяка, сурьмы | Проработать электролит, при большом содержании примесей электролит заменить |
| Пористые, рыхлые осадки | Наличие в электролите солей железа | |
| Светлые блестящие полосы на покрытии, осадки хрупкие | Присутствие в электролите органических примесей | Отфильтровать электролит, проработать его током |
Борфтористоводородный электролит обладает несколько более высокой рассеивающей способностью, чем сернокислый. Кроме того, в борфтористоводородных электролитах можно применять высокие плотности тока. Состав электролита (г/л) и режим меднения:
Кроме того, в борфтористоводородных электролитах можно применять высокие плотности тока. Состав электролита (г/л) и режим меднения:
Медь борфтористоводородная — 35-40 г/л
Кислота борная — 15-20 г/л
Кислота борфтористоводородная — 15-20 г/л
Никель хлористый — 50-70 г/л
Температура = 18-25°С
Плотность тока = до 10 А/дм 2
Электролит перемешивают сжатым воздухом или механической мешалкой.
Для приготовления борфтористоводородного электролита в борфтористоводородную кислоту небольшими порциями вводят свежеосажденную углекислую медь. Раствор углекислой меди готовят подливанием подогретого концентрированного раствора соды к раствору сернокислой меди при перемешивании. Полученный осадок декантируют, промывают и растворяют в борфтористоводородной кислоте. В приготовленный раствор добавляют свободную борфтористоводородную и борную кислоту до требуемого значения рН (1-1,5). В ванну с полученным электролитом доливают воду до рабочего уровня.
Гальваническое меднение металла | Механизмы процесса, методы
Содержание:
1. Что такое меднение? Назначение и обозначение медного покрытия.
Что такое меднение? Назначение и обозначение медного покрытия.
2. Кинетика процесса гальванического меднения.
1. Что такое меднение? Назначение и обозначение медного покрытия.
Меднение — процесс нанесения тонкого слоя металлической меди на изделие для придания ему необходимых свойств.
Медные покрытия широко применяются в основном в качестве подслоя при нанесении многослойных покрытий, а также для улучшения пайки, создания электропроводных слоёв, уплотнения резьбовых соединений, местной защиты стальных деталей при цементации. В редких случаях используются для придания декоративного внешнего вида.
Медь — металл розового цвета с атомной массой 63,5, плотностью 8,9 г/см3, температурой плавления 10830С, удельным электросопротивлением 0,017*Ом*мм. Медь пластична, твердость медных покрытий 2500-3000 МПа.
Медь интенсивно растворяется в аэрированных аммиачных и цианидных растворах, азотной кислоте, медленнее — в хромовой, слабо — в серной и почти не взаимодействует с соляной кислотой. На воздухе медь легко реагирует с влагой, углекислыми и сернистыми соединениями, окисляется и темнеет.
На воздухе медь легко реагирует с влагой, углекислыми и сернистыми соединениями, окисляется и темнеет.
Стандартный потенциал меди по отношению к ее одновалентным нонам +0,52 В, двухвалентным ионам +0,34 В.
В жестких условиях эксплуатации медь и ее сплавы не должны контактировать с хромом, оловом, сталями, цинком, кадмием, алюминием и магнием.
|
Обозначение покрытия |
М — стандартное меднение, блеск не нормируется М. б — меднение блестящее М24 — искровзрывозащитное меднение (толщина не менее 24мкм) М. ч — меднение с декоративным чернением (состариванием/патинированием) galvanic copper plating — англ. обозначение |
|
Толщина |
6-100мкм (оптимально, но возможно осадить большую толщину) |
|
Микротвердость |
590-1470 МПа (60-150 кгс/мм2) |
|
Удельное электрическое сопротивление при 18оC |
1,68⋅10-8 Ом⋅м |
|
Допустимая рабочая температура |
300оC
|
2.
 Кинетика процесса гальванического меднения.
Кинетика процесса гальванического меднения.Для электролитического осаждения меди разработано большое количество электролитов, которые, обычно, разделяют на две группы: кислые и щелочные. Существуют как простейшие, так и достаточно сложные композиции для меднения.
Катодные поляризационные кривые для некоторых из них приведены на рисунке 1.
Рисунок 1 — Катодные поляризационные кривые при меднении из электролитов: 1 — сульфатный; 2 — пирофосфатный; 3 — цианидный ; 4 -цианидный с повышенным содержанием свободных цианидов.
2.1 Процессы в кислых электролитах меднения.
К кислым электролитам относятся сульфатные и фторборатные электролиты. Их основные достоинства — простота состава и устойчивость в эксплуатации, но они обладают низкой рассеивающей способностью. Также из них невозможно непосредственно меднить сталь из-за выпадения контактной меди, а, следовательно, плохое сцепление со сталью слоя меди. Вследствие этого меднение осуществляется после предварительного осаждения медного слоя (3-4 мкм) из щелочных электролитов или после осаждения никелевого слоя (3-5 мкм).
Вследствие этого меднение осуществляется после предварительного осаждения медного слоя (3-4 мкм) из щелочных электролитов или после осаждения никелевого слоя (3-5 мкм).
Из кислых электролитов наиболее распространен сульфатный электролит. Основными компонентами сульфатных электролитов являются сульфат меди и серная кислота. Электропроводность нейтральных растворов сульфата меди невелика, поэтому в них добавляют серную кислоту, которая значительно повышает электропроводность растворов температуры перемешивания.
Предполагается, что на катоде разряд двухвалентных ионов меди протекает в две стадии:
Cu2++ e → Cu+
Cu+ + e → Cu
Замедленной стадией является первая реакция. Доля каждой стадии в общей кинетике меднения зависит от состава электролита и режима электролиза: плотности тока, температуры, перемешивания.
Выход меди по току около 100 %, так как выделения водорода на катоде не происходит, поскольку потенциалы выделения меди имеют более положительные значения, чем потенциалы выделения водорода.
Повышение кислотности электролита способствует уменьшению растворимости сульфата меди, что приводит к снижению верхнего предела допустимой плотности тока. Для увеличения концентрации ионов меди в катодном слое применяют перемешивание. В этом случае кислотность электролитов можно увеличивать. Чем интенсивнее перемешивание, тем выше может быть содержание серной кислоты. Повышение температуры способствует увеличению растворимости сульфата меди: при 25 °С — 23,05 г CuSO4 на 100 г воды; при 100 °С — 73,6 г. Повышенная кислотность способствует получению более мелкокристаллических осадков.
Вблизи анодов наряду с ионами Cu2+ в растворе могут находиться в незначительном количестве ионы одновалентной меди, образующиеся в результате протекания реакции:
Cu + Cu2+↔ 2Cu+
При накоплении в растворе ионов Cu+ равновесие будет сдвигаться влево, и металлическая медь будет выпадать в виде осадка.
При недостаточной кислотности раствора сульфат одновалентной меди будет гидролизоваться с образованием Сu(ОН)2 или СuО2
Cu2SO4 + H2O ↔ Cu2O + H2SO4
В результате в электролите будут взвешенные частицы металлической меди и оксида меди, которые, включаясь в катодный осадок, делают его темным, шероховатым, а иногда — рыхлым.
Присутствие серной кислоты способствует протеканию реакций окисления одновалентной меди:
Cu2SO4 + H2SO4 + 1/2О2→ 2CuSO4 + Н2О
Cu2O + 2H2SO4 + 1/2O2→ 2CuSO4 + 2H2O
Таким образом, серная кислота прежде всего нужна для предупреждения накопления ионов Cu+ и гидролиза ее солей.
В сульфатные электролиты меднения иногда вводят поверхностно-активные вещества. Эти вещества вводят для повышения катодной поляризации, что способствует получению более мелкозернистых плотных, иногда блестящих, осадков. Благоприятное действие этих добавок сказывается в том, что они предупреждают образование наростов на краях и выступающих частях деталей. Наилучшими добавками являются декстрин (не более 1 г/л) и фенол или его сульфосоединения (1-10 г/л).
Для получения блестящих медных покрытий предложено большое количество блескообразующих добавок, обеспечивающих зеркальный блеск покрытий, придающих им пластичность и снижающих внутренние напряжения.
При работе с электролитами для получения блестящих медных покрытий особое внимание следует уделять анодам. Анодный процесс растворения меди достаточно сложен и подробно описан в статье.
Взвешенные частицы шлама обычно являются причиной грубого шероховатого осадка. Вообще, медное покрытие особенно склонно к дендритообразованию при меднении с нарушением технологического процесса, к которому относится и присутствие шлама в растворе. Частички шлама становятся при этом центрами кристаллизации и ток, вместо того, чтобы идти на зарождение новых зерен меди, расходуется на обрастание и разрастание этих частиц. Дендриты могут появляться и по другим причинам, одной из которых также является превышение допустимой плотности тока на выступающих частях деталей. Примеры дендритов на медном покрытии приведены на рисунке 2. Пример дендрита на циллиндрическом катоде и поперечный рез такого дендрита приведены на рисунке 3.
Частички шлама становятся при этом центрами кристаллизации и ток, вместо того, чтобы идти на зарождение новых зерен меди, расходуется на обрастание и разрастание этих частиц. Дендриты могут появляться и по другим причинам, одной из которых также является превышение допустимой плотности тока на выступающих частях деталей. Примеры дендритов на медном покрытии приведены на рисунке 2. Пример дендрита на циллиндрическом катоде и поперечный рез такого дендрита приведены на рисунке 3.
Рисунок 2 — Примеры дендритов на медном покрытии.
Рисунок 3 — Пример дендрита на циллиндрическом катоде и поперечный рез такого дендрита.
На качество получаемых блестящих покрытий большое влияние оказывает концентрация ионов Сl—. При пониженной концентрации снижается блеск покрытий и образуются прижоги на острых кромках деталей, при повышенном содержании образуются полосы на покрытиях.
Вредными примесями в медных сульфатных электролитах являются мышьяк, сурьма, некоторые органические вещества, образующие коллоидные растворы, анодный шлам.
Кроме сульфатных, используют фторборатные электролиты. Эти электролиты обладают высокой устойчивостью; получающиеся покрытия плотные и мелкокристаллические, рассеивающая способность электролитов примерно такая же, как у сульфатных. Большая растворимость фторбората меди позволяет применять повышенные плотности тока. Из этих электролитов меднить стальные детали напрямую нельзя; необходим подслой никеля или меди из цианидных электролитов.
2.2 Процессы в щелочных электролитах меднения.
К щелочным электролитам относятся цианидные, пирофосфатные и этилендиаминовые электролиты. Основные достоинства: высокая рассеивающая способность, получение мелкокристаллических осадков, возможность непосредственно меднить стальные детали.
2.2.1 Цианистое меднение.
Довольно распространены цианидные электролиты. Условия осаждения меди из цианидных электролитов существенно отличаются от условий осаждения в кислых электролитах.
В цианидных электролитах медь находится в составе комплексных ионов, степень диссоциации, а, следовательно, и активность ионов меди очень мала. Поэтому потенциал выделения меди в них примерно на 0,9-1,2 В отрицательнее, чем в сульфатных растворах.
При малом количестве цианида аноды пассивируются. При недостаточном количестве свободного цианида, когда происходит пассивация анодов и на них разряжаются ионы ОН— с выделением кислорода, то не весь образующийся кислород выделяется в виде газа, а часть его расходуется на окисление цианида в цианит. Уменьшение содержания цианидов происходит также из-за взаимодействия их с углекислотой воздуха и образования карбонатов (NaCN → Na2CO3 ).
Содержание свободного цианида оказывает на катодный и анодный процессы противоположное влияние: для катодного процесса требуется минимальное содержание цианидов, для анодного — максимальное. При недостатке свободного KCN на анодах образуется зеленоватая пленка CuCN из-за того, что ионы меди не в состоянии перейти в комплексное соединение. Свободная поверхность анода уменьшается, плотность тока растет, и анодное растворение происходит с образованием ионов двухвалентной меди, которые в виде нерастворимого гидрата осаждаются на аноде. При этом аноды пассивируются и наблюдается интенсивное выделение кислорода.
Свободная поверхность анода уменьшается, плотность тока растет, и анодное растворение происходит с образованием ионов двухвалентной меди, которые в виде нерастворимого гидрата осаждаются на аноде. При этом аноды пассивируются и наблюдается интенсивное выделение кислорода.
Основными компонентами медных цианидных электролитов являются комплексный цианид меди и свободный цианид натрия. Из приведенных данных видно, что степень диссоциации комплексных ионов очень мала и уменьшается с увеличением содержания CN— в комплексе. Этим, по-видимому, объясняется повышение катодной поляризации при увеличении содержания свободного цианида в электролите.
Содержание меди в электролите во время работы обычно уменьшается вследствие недостаточной растворимости анодов. Снижение концентрации ионов меди в электролитах приводит к образованию пористых осадков. Кроме того, работая с малоконцентрированными медными электролитами, можно применять только пониженные плотности тока.
Постоянным компонентом цианидных электролитов является карбонат. Он накапливается в результате окисления цианида кислородом воздуха, особенно при нагревании:
2NaCN + 2Н2О + 2NaOH + О2 = 2Na2CO3 + 2NH3
Присутствие карбонатов в небольших количествах полезно, поскольку при этом повышается электропроводность электролитов. Однако при их накоплении свыше 70 г/л, а в концентрированных — до 140 г/л аноды проявляют склонность к пассивированию, а покрытия получаются пористыми. Карбонаты можно удалять при помощи хлорида бария и вымораживанием, охлаждая электролит до -5 °С. Следует отметить, что карбонаты натрия легче выпадают в осадок, чем калиевые. Сульфаты существенного влияния на процесс электролиза не оказывают.
Введение в электролит депассиваторов, в качестве которых применяют сегнетову соль KNaC4H4O6•4H2O и роданид калия KCNS, позволяет повысить рабочую плотность тока и устранить пассивацию анодов, но при этом следует одновременно повышать температуру электролита.
Высококонцентрированные по меди электролиты, содержащие депассиваторы, позволяют применять высокие плотности тока (до 10 А/дм2) при повышенной температуре и перемешивании. При этом возможно получить выход по току, близкий к 100 %.
Сульфиды, вводимые в электролит, играют роль восстановителя, предупреждая накопление в ванне ионов меди Cu2+.
Для замены ядовитых цианидных электролитов применяют пирофосфатные и этилендиаминовые электролиты.
2.2.2 Пирофосфатное меднение.
Из пирофосфатных электролитов получают медные осадки с мелкозернистой структурой. При нанесении тонких слоев осадки получаются гладкими, блестящими или полублестящими. Преимущества пирофосфатных электролитов перед кислыми заключаются в высокой рассеивающей способности и возможности непосредственно проводить меднение стальных деталей в разбавленном пирофосфатном электролите.
Основные компоненты пирофосфатных электролитов меднения: CuSO4 или Сu2Р2О7 и К4Р2О7 или Na4P2O7. В растворах в присутствии Na4P2O7 образуется комплексная соль Na6[Cu(P2O7)2]; при избытке свободного пирофосфата может образовываться Na2[Cu(P2O7)2]. Константы нестойкости комплексов [Сu(Р2О7)2]6- и [Сu(Р2О7)2]2- соответственно равны 3•10-3 и 2•10-9.
В растворах в присутствии Na4P2O7 образуется комплексная соль Na6[Cu(P2O7)2]; при избытке свободного пирофосфата может образовываться Na2[Cu(P2O7)2]. Константы нестойкости комплексов [Сu(Р2О7)2]6- и [Сu(Р2О7)2]2- соответственно равны 3•10-3 и 2•10-9.
В щелочных растворах при рН 8 и достаточном избытке свободных ионов Р2О74- медь находится преимущественно в виде шестизарядных комплексных ионов [Сu(Р2О7)2]6-.
В пирофосфатные электролиты вводят NH4NO3, который способствует повышению допустимой катодной и анодной плотностей тока и улучшает качество осадков. Из пирофосфатных электролитов можно получать блестящие осадки. В качестве блескообразующих добавок вводят Na2SeO3 совместно с лимонной или триоксиглутаровой кислотой, 2-меркаптотиазол и другие вещества.
При повышенных плотностях тока может происходить пассивация анодов за счет образования на их поверхности труднорастворимой оксидной или солевой пленки.
Катодный потенциал меди в пирофосфатных электролитах имеет более отрицательное значение, чем в кислых. Большая катодная поляризация объясняется пассивированием поверхности катода вследствие адсорбции ионов Р2О74- или образования оксидных (Сu2О8) и труднорастворимых соединений (Сu2Р2О7) в виде фазовой пленки.
Предполагают, что выделение меди на катоде из пирофосфатных растворов происходит в результате восстановления двухзарядных комплексов:
CuP2O72- + 2e—→ Cu + Р2О74-,
образующихся при диссоциации шестизарядных комплексов:
Cu(P2O7)26-↔ CuP2O72- + Р2О74-.
С повышением температуры ускоряется выделение меди, что связано как с ускорением диффузии комплексных анионов к катоду, так и с облегчением их разряда.
Структура осадков меди из пирофосфатного электролита более мелкая, по сравнению с сернокислымирастворами, с ростом плотности тока она укрупняется (рисунок 4)
Рисунок 4 — Микроизображения покрытия после меднения из пирофосфатного электролита при плотности тока 0,5 А/дм2 (слева) и 1 А/дм2 (справа).
Анодный выход по току в этих электролитах несколько выше катодного, поэтому при корректировке нет необходимости добавлять медные соли. Анодную плотность тока рекомендуется поддерживать в пределах 2-4 А/дм2. При более низкой плотности тока растворение идет недостаточно быстро, при более высокой — на поверхности анодов образуется труднорастворимая оксидная пленка.
Для предотвращения пассивации анодов должно быть достаточное количество свободных анионов Р2О74- и достаточно высокое рН раствора. Повышение температуры способствует отводу продуктов реакции и, следовательно, уменьшению пассивации анодов. Для этой же цели в электролиты вводят депассиваторы, которые способствуют снижению активности ионов Cu2+ в прианодном слое.
Повышение температуры способствует отводу продуктов реакции и, следовательно, уменьшению пассивации анодов. Для этой же цели в электролиты вводят депассиваторы, которые способствуют снижению активности ионов Cu2+ в прианодном слое.
При работе пирофосфатных ванн рекомендуется проводить фильтрацию электролита: для полублестящих осадков — периодически или непрерывно, для блестящих — непрерывно.
Особенностью этилендиаминовых электролитов меднения является возможность непосредственного меднения стальных деталей. Детали в ванну загружают под током плотностью в 3-5 раз превышающей рабочую.
Оцените статью. Всего 1 клик!
Данная статья является интеллектуальной собственностью ООО «НПП Электрохимия». Любое копирование информации возможно только с разрешения владельца сайта. Размещение активной индексируемой ссылки на https://zctc.ru обязательно.
технология и оборудование. Меднение металла в домашних условиях
Медь является одним из самых широко применяемых металлов в мире, еще издавна этот материал применяли для изготовления орудий труда. Такое активное использование меди обусловлено ее уникальными техническими и эксплуатационными свойствами. В настоящее время без меди невозможно существование таких отраслей производства, как металлургия, автомобильная промышленность, электротехника и строительство. Этот материал необходим и в бытовых условиях, именно поэтому многих так интересует, как проводить меднение в домашних условиях.
Такое активное использование меди обусловлено ее уникальными техническими и эксплуатационными свойствами. В настоящее время без меди невозможно существование таких отраслей производства, как металлургия, автомобильная промышленность, электротехника и строительство. Этот материал необходим и в бытовых условиях, именно поэтому многих так интересует, как проводить меднение в домашних условиях.
Под меднением принято понимать гальваническое нанесение меди, при этом толщина слоя должна находиться в рамках от одного до трехсот микрометров. Меднение – это покрытие медью металлического изделия в качестве подготовки к хромированию, использованию никеля или серебра. Однако данная процедура может использоваться и как самостоятельная обработка поверхности.
В качестве подготовительного процесса меднение стали способствует выравниванию поверхности, ведь, как известно, медь прочно держится на стали, чего не скажешь о других материалах. Различные металлы достаточно хорошо осаждаются на омедненное покрытие (намного лучше, чем на чистую сталь).
К отличительным характеристикам медного покрытия специалисты относят высокое сцепление с иными металлами, пластичность и надежность. Однако при постоянном воздействии факторов окружающей среды медное покрытие быстро окисляется и покрывается радужными разводами, пятнами и налетом.
Меднение можно производить на поверхностях из стали, цинка и даже алюминия. Только что нанесенный слой меди имеет малиновый оттенок со слегка заметным металлическим блеском.
Где используется?
Выделяют несколько основных случаев применения меднения:
- Для декорирования. В последнее время увеличился спрос на старинные медные изделия. При помощи специальной обработки нанесенный слой меди придает поверхности «состаренный вид».
- Данный способ нанесения железа используется для производства копий отдельных медных деталей различных форм и размеров. Сначала создается основа из воска или пластика, которую в последствии покрывают электропроводящим раствором и медным слоем.
 Такая технология широко применяется при изготовлении сувенирной продукции, ювелирных изделий, а также барельефов и волноводов.
Такая технология широко применяется при изготовлении сувенирной продукции, ювелирных изделий, а также барельефов и волноводов. - В электротехнике. Низкая стоимость меднения выгодно выделяет этот метод – по сравнению с покрытиями из серебра или золота, медные изделия могут применяться в электротехнических отраслях (для производства электродов, контактов под напряжением и в качестве основы под пайку).
Технологию меднения также совмещают с различными типами гальванизации:
- Для создания многослойного декоративного покрытия со слабыми защитными характеристиками. В таком случае используется медь, хром и никель – трехслойный защитно-декоративный слой, который повышает степень сцепления с основным материалом поверхности.
- Для защиты определённого участка детали при цементации. При гальванизации свинцовых изделий медью необходимо предохранение покрытий стальных элементов от науглероживания. Меднению поддаются только те участки, которые в дальнейшем будут подвергаться механической обработке.

- При реставрационных работах. В процессе омеднения на восстанавливаемой детали образуется промежуточный слой, который в дальнейшем послужит основой для более прочного покрытия (хромирования, никелирования). Для гальванического способа характерно нанесение толстого слоя меди, до двухсот пятидесяти микрометров. Это связано с необходимостью ликвидации всех повреждений и дефектов поверхности.
На видео: гальваническое меднение в декоративных целях.
Особенности процесса в быту
Омеднение металлических предметов носит название – гальваностегия. Принцип заключается в погружении предмета в раствор электролита с осажденным медным купоросом. Мало кто знает, что гальванизацию можно проводить и в домашних условиях, для этого не требуется наличие специального оборудование. Данная операция способствует подготовке поверхности к последующим обработкам либо служит промежуточной стадией при нанесении никеля, хрома, латуни.
Изделия, обработанные таким способом, с добавлением в медь других металлов, весьма устойчивы к агрессивным факторам. Меднение не предполагает особых навыков и профессиональных знаний, однако есть несколько нюансов, которые необходимо учитывать.
Меднение не предполагает особых навыков и профессиональных знаний, однако есть несколько нюансов, которые необходимо учитывать.
В быту осуществляется именно химическая гальванизация небольших деталей, поскольку она не требует больших финансовых затрат и дополнительного оборудования.
На видео: принцип меднения металлических предметов.
Как проводится химическое меднение на дому?
Чтобы нанести медь в домашних условиях, вам в первую очередь необходимо приготовить рабочий раствор и создать два разноименных электрода, так как в процессе омеднения ионы меди, находящиеся в электролитическом растворе, будут притягиваться к отрицательному полюсу. Нанесение на металлическую поверхность меди в промышленных условиях и в промышленных масштабах чаще всего используется как завершающая операция в обработке изделия.
Однако если вы собираетесь проводить меднение металла собственными силами, то должны знать порядок работы. Далее мы рассмотрим, как покрыть деталь медью в домашних условиях химическим способом с погружением в раствор электролита. Этот процесс легко можно выполнить на дому, если знать все особенности применения меди. Алгоритм выполнения:
Этот процесс легко можно выполнить на дому, если знать все особенности применения меди. Алгоритм выполнения:
1. Для растворителя меди на металле можно взять обычный аккумуляторный электролит. Он продается в любом хозяйственном магазине, однако его можно изготовить и собственными силами. Необходимо соблюдать пропорцию 100:3 дистиллированной воды и серной кислоты с поправкой на необходимый объем электролита. Затем в смесь добавляется до 20 грамм сульфата меди (медный купорос).
Важно! К медному купоросу могут добавляться и другие специализированные составы, в зависимости от конченой цели.
2. Предварительно деталь необходимо очистить абразивными материалами, для удаления оксидного слоя. Далее поверхность покрываемой детали обезжиривается горячим раствором карбоната натрия и промывается проточной водой (чтобы на металлах не скапливались различные загрязнения).
3. Гальванизационная емкость заполняется электролитическим раствором до нужного объема, после чего в раствор помещаются две медные пластины (на покрытиях которых будут образовываться ионы меди) на проводниках, а между ними размещается деталь, предназначенная для омеднения.
4. Концы проводников и подвесы для детали подключаются к источнику тока, в качестве которого могут выступать гальванические элементы либо аккумуляторные батареи (плюс на пластины, минус на деталь). В цепь предварительно необходимо последовательно подключить амперметр и реостат.
5. Процесс гальванизации занимает от пятнадцати до двадцати минут, после чего нужно отключить электропитание и извлечь деталь из раствора. Этого времени достаточно чтобы деталь покрылась тонким слоем меди. Для получения более толстого покрытия необходимо увеличить продолжительность процесса. Металлическая поверхность становится более прочной, повышаются ее технические и эксплуатационные свойства.
Как сделать раствор для домашнего меднения (3 видео)
Детали покрытые медью (25 фото)
Освоить технологию гальванического покрытия металлами материалов можно довольно быстро, для этого не потребуются обширные познания в физике или химии, а вот представление о том, что вы хотите получить «на выходе» — все же желательно иметь:)
Сам принцип омеднения заключается в осаждении меди на поверхности предмета-основы с помощью электро-химической обработки формы-полуфабриката.
По большому счету, доступный способ покрытия форм медью — всего один.
Технология омеднения различных неметаллических предметов называется «гальванопластика» («электроформинг» — западный аналог названия). Гальванопластическим способом вполне возможно изготовить самые разнообразные детали украшений.
Необходимым условием получения качественного медного покрытия является точное соблюдение технологии меднения. Итак, перейдем к созданию установки для омеднения.
Омеднение (меднение) производят в емкостях, имеющих обычно округлую или прямоугольную форму. Другая форма емкости так же не помешает процессу. Объем емкости определяется размером и количеством изделий (предметов), подлежащих меднению. Вполне подходят глазурованные емкости из керамики, стекла или пластмассы .
Вам понадобится источник постоянного тока низкого напряжения (от 2 до 6В). Для этого идеально подходит выпрямители для зарядки аккумуляторов, а если такового в вашем хозяйстве не обнаружилось, то сойдут и аккумуляторные батареи или элементы питания (батарейки).
Силу тока регулировать можно с помощью ползункового реостата (не пугайтесь, его можно заметить подходящим переменным резистором, это выглядит как регулятор громкости, такая ручка или бегунок).
Так же понадобится мультиметр для контроля силы тока (от 0 до 3-5 ампер) и для измерения напряжения. Как правило, амперметр на зарядных устройствах все же присутствует и отдельно его приобретать не нужно.
Для создания электролита запаситесь медным купоросом и серной кислотой . Вместо серной кислоты прекрасно подходит электролит, которым обычно заправляют аккумуляторы для автомобилей.
Для нанесения токопроводящего слоя на поверхность детали, подлежащей омеднению, потребуется токопроводящий лак .
В качестве анода можно использовать медные пластины , а за неимением таковых — обычную медную проволоку — жилу, добытую из обычного силового кабеля, который можно купить в любом магазине электротехнических товаров. Площадь этой пластины или проволоки должна быть примерно равна площади покрываемого медью предмета, в любом случае — чем она больше, тем лучше. Задача анода — потихоньку растворяться, отдавая медь в раствор .
Площадь этой пластины или проволоки должна быть примерно равна площади покрываемого медью предмета, в любом случае — чем она больше, тем лучше. Задача анода — потихоньку растворяться, отдавая медь в раствор .
Еще для омеднения необходим будет этиловый спирт .
Электролит приготавливается следующим образом :
на 1 литр воды берется 230-250 грамм медного купороса и 40-50 мл. серной кислоты (серную кислоту можно приобрести в виде состава с названием «Электролит» в авто и хозяйственных магазинах).
* Будьте осторожны при обращении с электролитом — он может повредить кожу, глаза и даже ткань одежды.
* Следует помнить, хотя растворы не содержат сильно ядовитых веществ, но обращаться с ними все же следует с определенной осторожностью, чтобы не получить отравление или ожог.
* Растворы целесообразно хранить в темной стеклянной емкости с хорошо закрывающейся крышкой (но прекрасно подойдет и обычная пластиковая бутылка).
Гальваника представляет собой раздел электрохимической науки, которая изучает осаждение некоторых элементов на любую поверхность. С помощью гальваники в домашних условиях или в промышленности можно нанести на изделие тонкий слой металла, который будет выступать в роли защитного слоя или выполнять декоративные функции. В последнее время декоративное покрытие набирает популярность у тех, кто хочет сделать оригинальный подарок своим друзьям и родным.
С помощью гальваники в домашних условиях или в промышленности можно нанести на изделие тонкий слой металла, который будет выступать в роли защитного слоя или выполнять декоративные функции. В последнее время декоративное покрытие набирает популярность у тех, кто хочет сделать оригинальный подарок своим друзьям и родным.
Общие сведения
Покрытие гальваникой бывает технологическим или декоративно-защитным. Это тонкий металлический тонкий слой, который в зависимости от гальванических элементов может выполнять эстетические функции. Гальванопластика не увеличивает прочность изделия, поскольку в этом случае требуются большие производственные мощности, но для красоты и придания «свежести» вполне подойдет.
Гальванические реакции происходят с помощью постоянного электрического тока. В специальную емкость-диэлектрик наливают раствор — электролит, в который погружают два анода. Аноды должны быть изготовлены из металла, который будет осаждаться на покрываемом изделии.
Обрабатываемая деталь присоединяется к минусовому выводу и помещается между анодами. Она выполняет роль катода. Аноды, в свою очередь, присоединяются к плюсовому контакту источника питания. Они становятся частью цепи, проводя ток в электролит и отдавая ему свои металлические элементы. Электролит передает необходимые частицы обрабатываемой детали, они постепенно обволакивают её тонким слоем. Аноды по площади должны превышать в несколько раз размер заготовки.
Другими словами, гальванизация представляет собой перенос молекул металла раствора на изделие в момент протекания через них электротока.
Любой гальванический процесс можно разбить на общие этапы:
- Сборка гальванической установки.
- Подготовка электролитного раствора.
- Обработка и подготовка образца.
- Запуск гальванического процесса.
Оборудование можно подготовить самостоятельно. Сначала подбирается подходящий источник питания. Это может быть батарейка (для обработки изделий небольшого размера) или аккумулятор. Подойдет понижающий блок питания, который выдает на выходе постоянный ток до 12 вольт. Иногда используют инвертор от сварочного аппарата. Подбирается реостат для регулирования силы тока.
Подойдет понижающий блок питания, который выдает на выходе постоянный ток до 12 вольт. Иногда используют инвертор от сварочного аппарата. Подбирается реостат для регулирования силы тока.
Из нейтрального, устойчивого к химически агрессивным веществам материала подбирается широкая и глубокая ванночка. Надо учитывать, что электролитический раствор при гальваническом процессе может нагреваться до девяноста градусов по Цельсию.
Подготавливаются две пластины, которые будут токопроводящими анодами.
Для нагрева ёмкости с электролитом нужен электрический прибор с возможностью плавной регулировки температурного режима. Чаще всего используют подошву утюга или небольшую электроплитку. С их помощью происходит нагрев раствора до необходимой температуры и ускорение реакции.
Химические реактивы необходимо хранить в плотно закупоренной стеклянной посуде. Желательно каждый предмет подписывать.
Потребуются весы для точного измерения массы веществ, поскольку необходимая точность веса компонентов составляет один грамм. Такие весы можно приобрести, а можно сделать самостоятельно, используя вместо гирек старые советские монеты. Вес «желтых» монет точно соответствует их номиналу.
Такие весы можно приобрести, а можно сделать самостоятельно, используя вместо гирек старые советские монеты. Вес «желтых» монет точно соответствует их номиналу.
После того как собраны необходимые вещества, найдены ёмкости, собрана электрическая схема с питанием и подготовлена система подогрева, можно заняться чисткой заготовки.
Если недостаточно хорошо почистить деталь, гальваническое покрытие непрочно осядет или будет неравномерным. Иногда хватает простого обезжиривания предмета. Раствор ацетона или спирта может хорошо обезжирить поверхность, можно использовать бензин.
Некоторые мастера держат изделия из стали в разогретом до 90 градусов по Цельсию растворе фосфорнокислого натрия. Цветные металлы можно очищать в том же растворе, не нагревая его.
Если на изделии есть коррозия или другие изъяны, то поверхность заготовки шлифуется наждачной бумагой.
Иногда про технику безопасности при различных работах в домашних условиях рассказывают вскользь. Но при выполнении любых гальванических работ нужно строго соблюдать безопасность.
Но при выполнении любых гальванических работ нужно строго соблюдать безопасность.
Опасность заключается в использовании токсичных химических веществ, высокой температуре нагрева раствора и повышенными рисками, которые сопровождают электрохимические реакции.
Лучше всего гальванические работы проводить в гараже или мастерской при обязательном проветривании или вентилировании помещения. Особое внимание следует уделить заземлению оборудования. Нужно соблюдать меры личной безопасности, а именно:
- Дыхательные пути следует защитить респиратором.
- Руки и запястья должны быть спрятаны в высокие и прочные резиновые перчатки.
- Обувь должна защищать от ожогов, а одежда прикрыта клеенчатым фартуком.
- Обязательно ношение специальных защитных очков.
Перед началом работ по меднению в домашних условиях нужно подготовить необходимые материалы и оборудование. Надо позаботится об источнике напряжения и постоянного тока. Существует много рекомендаций касательно силы тока, разброс которого может быть большим. Поэтому желательно иметь реостат с возможностью плавной регулировки напряжения и для постепенного завершения процесса. Источником может служить автомобильный аккумулятор или выпрямитель с напряжением на выходе не больше 12 вольт. Для первых опытов будет достаточно обычной батарейки от 4.5 до 9 вольт.
Поэтому желательно иметь реостат с возможностью плавной регулировки напряжения и для постепенного завершения процесса. Источником может служить автомобильный аккумулятор или выпрямитель с напряжением на выходе не больше 12 вольт. Для первых опытов будет достаточно обычной батарейки от 4.5 до 9 вольт.
Затем выбирается ёмкость для электролитического раствора, лучше всего из жаропрочного стекла. В любом случае все ёмкости для электролиза должны быть диэлектриками и выдерживать температуру не менее, чем 80 градусов по Цельсию.
В качестве анодов подойдут два больших медных листа. Они должны перекрывать по размеру заготовку. Из химических реактивов потребуются:
- Купорос медный.
- Кислота соляная либо серная.
- Вода дистиллированная.
Меднение в домашних условиях пользуется заслуженной популярностью, поскольку очень хорошо и надежно держится на стальных изделиях. Главное условие — правильно соблюдать технологию процесса.
Имеется два способа нанесения меди на поверхность:
- Помещение заготовки в раствор электролита.

- Неконтактный способ. В этом случае изделие не погружается в раствор.
Подготавливается и обрабатывается поверхность изделия при помощи тонкого наждака и щеточки. После этого деталь моется в проточной воде, обезжиривается и еще раз промывается.
Этапы процесса омеднения следующие:
- Два медных анода подключают в сеть к положительным контактам и размещают их в стеклянную банку.
- К обработанному изделию подводят контакт с отрицательным значением напряжения и свободно подвешивают между анодами.
- Подключают реостат согласно электрической схеме для возможности регулирования силы тока.
- Подготавливается раствор в правильных пропорциях. На 100 г дистиллированной воды надо 20 г медного купороса и 2−3 г соляной кислоты. Вместо соляной кислоты можно использовать другую.
- Раствор выливается в посуду с медными пластинами и деталью таким образом, чтобы они полностью скрылись под поверхностью раствора.
- Подключается источник напряжения.
 Реостатом добиваются необходимой силы тока из примерного расчета 10−15 миллиампер на каждый квадратный сантиметр площади детали.
Реостатом добиваются необходимой силы тока из примерного расчета 10−15 миллиампер на каждый квадратный сантиметр площади детали.
Весь процесс занимает примерно 15−20 минут. После обязательного выключения источника питания и остывания раствора готовое изделие с медным слоем на поверхности вынимается из банки.
Этот метод интересен тем, что его можно использовать для обработки не только стальных предметов, но и сделанных из других материалов. Например, алюминия и цинка. Порядок процесса следующий:
- Из многожильного медного провода изготавливается «кисточка». Конец провода оголяется. Из медных проводков создается подобие кисточки, чтобы затем прикрепить ее к деревянной ручке-держателю.
- Второй конец провода подключается к плюсовому контакту электрической цепи.
- В широкую ёмкость заливается стандартный электролитный раствор из медного купороса и соляной кислоты.
- Предварительно очищенная и промытая металлическая заготовка присоединяется к отрицательному контакту и размещается в пустой ёмкости.

- Импровизированная кисточка окунается в раствор электролита и проводится по поверхности заготовки без контакта. Это действие повторяется до получения результата.
Когда деталь полностью покроется слоем меди, выключается блок питания и процесс завершается. Деталь ополаскивается в воде и просушивается.
Часто с помощью медного электролиза обновляют столовые приборы, сделанные из алюминия. Если нет опыта проведения этого процесса, то можно потренироваться нанести медь на алюминиевые пластинки. Порядок проведения процесса:
Гальванопластика — это электрохимический способ придания предмету определенной формы с помощью осаждения на него металла. Чаще всего этот метод используют при обработке металлом неметаллических предметов или при изготовлении копий ювелирных изделий.
Если при гальванопластике изделие не обладает электропроводящими свойствами, то его предварительно покрывают графитом, иногда бронзой. Затем мастер делает с копии слепок и начинает гальванический процесс. В качестве материала слепка используют гипс, графит или легко плавящийся металл.
В качестве материала слепка используют гипс, графит или легко плавящийся металл.
Гальваника — это очень интересный и познавательный процесс, но он связан с активными веществами, которые могут навредить здоровью и нанести вред имуществу или окружающей среде. Поэтому перед тем как начинать гальванику своими руками, нужно принять все меры безопасности, изучить немного теории процесса и особенности поведения химических реактивов.
Меднение — это процесс нанесения на поверхность медного слоя гальваническим способом.
Медный слой придает изделию внешнюю привлекательность, что позволяет использовать прием гальванического покрытия медью в дизайнерских проектах. Также он придает металлу высокую электропроводность, что позволяет подвергать изделие дальнейшей поверхностной обработке.
Меднение можно использовать в качестве основного процесса для создания поверхностного слоя, а также как промежуточную операцию для дальнейшего нанесения другого металлического слоя. К такому способу можно отнести, например, процесс серебрения, или никелирования.
Меднение можно проводить в домашних условиях. Это дает возможность решить много бытовых проблем.
Чтобы выполнить покрытие медным слоем самостоятельно, нужно приобрести необходимое для процесса оборудование и материалы.
Прежде всего, нужно подготовить источник электрического тока. Разные домашние мастера советуют использовать силу тока, разброс которой в большом диапазоне. Работа должна проводиться на постоянном токе.
В качестве источника тока можно взять батарейку КБС-Л напряжением 4,5 вольт или новую батарейку марки «Крона» с рабочим напряжением 9 вольт. Можно также вместо нее использовать выпрямитель малой мощности, дающий напряжение не более 12 вольт, или автомобильный аккумулятор.
Обязательным является использование реостата для регулировки напряжения и плавного выхода из процесса.
Для раствора электролита должна быть заготовлена нейтральная емкость, например из стекла, а также пластиковая широкая посуда, имеющая достаточные размеры для размещения в ней детали. Емкости должны выдерживать температуру не менее 80оС.
Емкости должны выдерживать температуру не менее 80оС.
Также понадобятся аноды, обеспечивающие покрытие всей поверхности детали. Они предназначены для подведения тока в электролитный раствор и его распределение по всей площади детали.
Для проведения гальваники в домашних условиях понадобятся также химреактивы для приготовления раствора:
- медный купорос,
- соляная или другая кислота,
- дистиллированная вода.
Заготовив все необходимое, можно приступать к работе.
Меднение стальных изделий
Меднение стали медным купоросом является одним из основных процессов в области гальваники потому, что оно используется для предварительного покрытия медью. Она отличается высокой адгезией к стальной поверхности, в отличие от других металлов, которые не обладают хорошим сцеплением со сталью. Медный слой при соблюдении технологии держится на стальных изделиях прекрасно.
Есть две технологии нанесения покрытия: с погружением изделия в электролитный раствор и способ неконтактного покрытия поверхности медью без помещения в жидкий электролитный раствор.
Меднение путем погружения в раствор
Процесс выполняется с соблюдением следующих этапов:
- С поверхности стальной детали удаляется окисная пленка с помощью наждачной бумаги и щетки, а затем деталь промывается и обезжиривается содой с финишной промывкой водой.
- В стеклянную банку помещаются две медные пластины, подсоединенные к медным проводникам, которые служат анодом. Для этого их соединяют вместе и подводят к положительной клемме прибора, используемого в качестве источника тока.
- Между пластинами свободно подвешивается обрабатываемая деталь. К ней подводится отрицательный полюс клеммы.
- В цепь встраивается тестер с реостатом, чтобы регулировать силу тока.
- Готовится электролитный раствор, в состав которого обычно входит медный купорос — 20 грамм, кислота (соляная или серная) — от 2 до 3 мл, растворенная в 100 мл (лучше дистиллированной) воды.
- Готовый раствор заливается в подготовленную стеклянную банку. Он должен покрыть помещенные в банку электроды полностью.

- Электроды подключаются к источнику тока. С помощью реостата устанавливается ток (10-15 мА должны приходиться на 1см2 площади детали).
- Через 20-30 минут ток отключается, и деталь, покрытая медью, достается из емкости.
Покрытие медью без помещения в электролитный раствор
Такой способ используется не только для стальных изделий, но и алюминиевых предметов и изделий из цинка. Процесс осуществляется так:
- Берется многожильный медный провод, с одного конца которого снимается изоляционное покрытие, а проводкам из меди придается вид своеобразной кисточки. Для удобного использования «кисть» закрепляют на ручке — держателе (можно взять деревянную палку).
- Другой конец провода без кисти подсоединяется к положительной клемме используемого источника напряжения.
- Готовится электролитный раствор на основе концентрированного медного купороса с добавлением небольшого количества кислоты. Он наливается в широкую емкость, необходимую для удобного окунания кисти.

- Подготовленная металлическая деталь, очищенная от оксидной пленки и обезжиренная, помещается в пустую ванночку и подсоединяется к отрицательной клемме.
- Кисть смачивается приготовленным раствором и водится вдоль поверхности пластины, не прикасаясь к ней.
- После достижения необходимого медного слоя, процесс заканчивается, а деталь промывается и сушится.
Между поверхностью детали и импровизированной медной кистью всегда должен быть слой из раствора электролита, поэтому кисть необходимо обмакивать в электролит постоянно.
Меднение алюминия медным купоросом
Нанесение на поверхность меди — отличный способ обновления алюминиевых столовых приборов и других изделий из алюминия, используемых дома.
Меднение алюминия медным купоросом можно провести самостоятельно. Упрощенный вариант для демонстрации процесса — это покрытие медью алюминиевой пластинки простой формы.
На этом примере можно потренироваться. Выполнение процесса происходит так:
Выполнение процесса происходит так:
1. Поверхность пластинки необходимо сначала зачистить, а затем обезжирить.
2. Затем нужно нанести на нее немного концентрированного раствора сернокислой меди (медного купороса).
3. Следующим действием является подсоединение к алюминиевой пластинке провода, подсоединенного к отрицательному полюсу. Подсоединять провод к пластинке можно с помощью обычного зажима.
4. Положительный заряд подается на устройство, состоящее из оголенного медного провода с диаметром от 1 до 1,5 мм, конец которого распределяется между щетинами зубной щетки.
Во время работы этот конец провода не должен касаться поверхности алюминиевой пластины.
5. Обмакнув щетину в раствор медного купороса, начинают водить щеткой в подготовленном для покрытия медью месте. При этом не нужно допускать замыкания цепи, прикасаясь к поверхности алюминиевой пластины концом медного провода.
6. Омеднение поверхности сразу становится визуально заметно. Чтобы слой был качественным, с окончанием процесса не нужно торопиться.
Чтобы слой был качественным, с окончанием процесса не нужно торопиться.
7. После завершения работы слой меди нужно выровнять дополнительной очисткой, удалив остатки медного купороса и протерев поверхность спиртом.
Гальванопластика в домашних условиях
Гальванопластикой называют процесс электрохимического воздействия на изделие с целью придания ему необходимой формы осаждаемым на поверхности металлом.
Обычно эту технологию используют для покрытия металлом неметаллических изделий. Широко применяют ее в ювелирной области и дизайне бытовых предметов.
Медные покрытия, как правило, не применяются в качестве самостоятельного покрытия ни для декоративных целей, ни для защиты стальных деталей от коррозии.
Это связано с тем, что медь в атмосферных условиях легко окисляется, покрываясь налетом окислов.
Однако благодаря хорошему сцеплению осажденной меди с различными металлами медное покрытие применяется в многослойных защитно-декоративных покрытиях в качестве промежуточного подслоя, а также для защиты стальных деталей от цементации.
В гальванопластике медные осадки применяются для изготовления металлических копий, барельефов, волноводов и матриц.
Электролиты меднения подразделяют на кислые и щелочные . Из кислых электролитов используют сернокислые и борфтористоводородные. Наибольшее применение нашли сернокислые электролиты, отличающиеся простотой состава, устойчивостью и высоким выходом по току (до 100%). Недостатком этих электролитов является невозможность непосредственного покрытия стальных и цинковых деталей вследствие контактного выделения меди, имеющей плохое сцепление с основным металлом.
Поэтому перед меднением стальных детален в кислых электролитах их предварительно меднят в цианистых электролитах или осаждают тонкий подслой никеля. К недостаткам сернокислых электролитов относятся также их незначительная рассеивающая способность и более грубая: структура осадков по сравнению с другими электролитами.
К щелочным электролитам меднения относятся цианистые, пирофосфатные и другие электролиты.
Цианистые медные электролиты обладают высокой рассеивающей способностью, мелкокристаллической структурой осадков, возможностью непосредственного меднения стольных деталей. К недостаткам относятся низкая плотность тока и неустойчивость состава вследствие карбонизации свободного цианида под действием двуокиси углерода воздуха. Кроме того, цианистые электролиты характеризуются пониженным выходом по току (не более 60-70%).
Кислые электролиты меднения
Медь сернокислая — 150-250 г/л
Никель хлористый — 50-70 г/л
Температура = 18-25°С
Плотность тока = 1-4 А/дм2
При перемешивании электролита сжатым воздухом можно довести катодную плотность тока до 6-8 А/дм2.
Для приготовления сернокислого электролита меднения растворяют медный купорос, фильтруют его в рабочую ванну и при непрерывном помешивании добавляют серную кислоту.
При нанесении медных покрытий из сернокислого электролита медные аноды растворяются в основном с образованием двухвалентных ионов, которые, разряжаясь на катоде, осаждаются в виде металлической меди.
Однако наряду с этими процессами происходят п другие, нарушающие нормальное течение электролиза. Возможно также анодное растворение с образованием одновалентных ионов, хотя и в меньшей степени.
В электролите, омывающем металлическую медь, идет также химический обратимый процесс: Cu + Cu2+ = 2Cu+.
Накопление в растворе ионов одновалентной меди в больших количествах приводит к сдвигу реакции влево, в результате чего выпадает металлическая губчатая медь.
В растворе, кроме того, происходит окисление сернокислой одновалентной меди за счет кислорода воздуха н серной кислоты, особенно при воздушном перемешивании: Cu2SO4 + ½O2 + h3SO4 = 2CuSO4 + h3O.
На катоде процесс заключается в разряде двухвалентных и одновалентных ионов меди, но в связи с тем, что концентрация ионов одновалентной меди приблизительно в 1000 раз меньше концентрации ионов двухвалентной меди, катодный процесс выглядит так: Cu2+ + 2е- = Cu. Выход по току составляет 100%.
Для получения плотного гладкого осадка в электролите необходимо присутствие серной кислоты.
Меднение гальваникой и гальванопластика в домашних условиях
Серная кислота выполняет ряд функций:
значительно повышает электропроводность электролита;
понижает активность ионов меди, что способствует образованию мелкозернистых осадков;
предотвращает гидролиз сернокислой закисной меди, который сопровождается образованием рыхлого осадка закиси меди.
Дефекты при эксплуатации сернокислого электролита меднения и способы их устранения
Причина дефекта | Способ устранения | |
Грубая крупнокристаллическая структура осадков | Недостаток кислоты | Добавить кислоту |
Высокая плотность тока | Снизить плотность тока | |
Шероховатые осадки | Загрязнение электролита механическими примесями | Отфильтровать электролит |
Черные и коричневые полосы на покрытии | Присутствие в электролите примесей тяжелых металлов, мышьяка, сурьмы | Проработать электролит, при большом содержании примесей электролит заменить |
Пористые, рыхлые осадки | Наличие в электролите солей железа | |
Светлые блестящие полосы на покрытии, осадки хрупкие | Присутствие в электролите органических примесей | Отфильтровать электролит, проработать его током |
Борфтористоводородный электролит обладает несколько более высокой рассеивающей способностью, чем сернокислый.
Кроме того, в борфтористоводородных электролитах можно применять высокие плотности тока. Состав электролита (г/л) и режим меднения:
Медь борфтористоводородная – 35-40 г/л
Кислота борная – 15-20 г/л
Кислота борфтористоводородная – 15-20 г/л
Никель хлористый – 50-70 г/л
Температура = 18-25°С
Плотность тока = до 10 А/дм2
Электролит перемешивают сжатым воздухом или механической мешалкой.
Для приготовления борфтористоводородного электролита в борфтористоводородную кислоту небольшими порциями вводят свежеосажденную углекислую медь.
Раствор углекислой меди готовят подливанием подогретого концентрированного раствора соды к раствору сернокислой меди при перемешивании. Полученный осадок декантируют, промывают и растворяют в борфтористоводородной кислоте. В приготовленный раствор добавляют свободную борфтористоводородную и борную кислоту до требуемого значения рН (1-1,5). В ванну с полученным электролитом доливают воду до рабочего уровня.
(Деканта́ция, деканти́рование — в химической лабораторной практике и химической технологии механическое отделение твёрдой фазы дисперсной системы (суспензии) от жидкой путём сливания раствора с осадка.)
Электрохимический процесс — электро-тип, то есть. осаждение более толстого массивного слоя металла на поверхность объекта, форма которого должна быть распространена, скопирована, достаточно распределена. Например, гальванопластика используется в тех случаях, когда металлическая деталь имеет очень сложную форму и ее трудно или невозможно изготовить обычными способами (литье или механическая обработка).
Таким образом, скульптуры иногда воспроизводятся по образцам (автомобиль «Аполлон» на пьедестале Большого театра выполнен гальванопластикой).
Этот процесс относительно прост и может быть легко воспроизведен в домашних условиях.
Печать копируется из статьи или статьи для копирования, то есть из легкого металла, воска, пластика или гипса. Субъект, который нужно скопировать, вымыть с мылом, добавляется к картонной коробке и выливается низкоплавким сплавом из древесины или других сплавов.
После литья объект удаляют и полученную форму обезжиривают и ударяют путем литья в электролитической ванне.
Чтобы не откладывать металл по бокам формы, где нет никакого впечатления, они покрываются щеткой с расплавленным воском или парафином. После литья меди низкоплавкий металл растворяется в кипящей воде и получается матрица. Матрица заливается штукатуркой или свинцом, и копия готова. Следующая композиция для воска используется для изготовления пресс-форм:
Воск …………… 20 веков.
Гальванический. Бейкер, покрывающий алюминий.
час
Парафин ……… 3 v. час
Графит ……….. 1 v. час
Если форма изготовлена из диэлектрика (воск, пластик, парафин, гипс), его поверхность
покрытый электропроводящим слоем.
Передаточный слой может быть осажден с извлечением определенных металлов (серебра, меди, никеля) или механическими средствами — путем протирания поверхности графитом в виде листьев из щетки мягких волос.
Графит тщательно измельчают в фарфоровом растворе, просеивают через сито или марлю и наносят на поверхность продукта мягкой кистью или ватой. Графит лучше держит глину. Формы гипса, дерева, стекла, пластика и папье-маше покрыты раствором воска в бензине. На поверхности, которая не успевает высохнуть, поместите графит в порошок и излишек, без контроля графита.
Графит лучше держит глину. Формы гипса, дерева, стекла, пластика и папье-маше покрыты раствором воска в бензине. На поверхности, которая не успевает высохнуть, поместите графит в порошок и излишек, без контроля графита.
Гальваническое покрытие просто отделено от графитовой формы. Если форма выполнена из металла, необходимо создать проводящую фольгу из оксида, сульфида или другой нерастворимой соли, такую как серебро — серебросодержащий хлорид свинца — сульфид свинца, чтобы обеспечить хорошее отделение от покрытия.
Медь, серебро и свинцовые поверхности обрабатываются 1% раствором сульфида натрия, что приводит к образованию нерастворимых сульфидов.
Отложение металла на поверхности пресс-формы. Готовая форма погружается в гальваническую ванну, схема которой находится под напряжением, так что снимаемая пленка не растворяется. Во-первых, «уплотнение» (покрытие) проводящего слоя меди осуществляется при низкой плотности тока в растворе этого
состав:
Серокислотная медь (сульфат меди) … 150-200 г.
Серная кислота 7-15 г
Этиловый спирт 30-50 мл
Вода …………………………………………. 1000 мл
Рабочая температура электролита составляет 18-25 ° С, плотность тока составляет 1 — 2 А / дм2.
Алкоголь необходим для
увеличить смачиваемость поверхности. Когда вся поверхность «подталкивается» медным слоем, форма переносится на электролит, предназначенный для гальванопластики. При гальванизации (медь) рекомендуется следующая композиция:
Серийно кислотная медь (сульфат меди) …..
340 c. час
Серная кислота 2 v. час
Вода …………………………………………. .1000 v. час
Температура электролита составляет 25-28 ° С. Плотность тока составляет 5-8 А / дм2.
Используя метод электроформовки, вы можете взять металлическое кружево для декоративно-художественного декоративно-художественного оформления различных предметов. Кружево растягивается на раме и пропитано парафином.
Затем вы протираете их между бумажными листами, чтобы удалить лишний парафин. Затем наносят электропроводящий слой тонкого графита, а избыток тщательно подталкивают кружевом. Путь провода — край кружева, он прикреплен к пластиковой раме или раме толстой проволоки с изолированным винилхлоридом вместе с кружевом, погруженным в электролит.
Путь провода — край кружева, он прикреплен к пластиковой раме или раме толстой проволоки с изолированным винилхлоридом вместе с кружевом, погруженным в электролит.
Лак, покрытый медью, обрабатывается латунной щеткой. Припаяйте их свинцовым припоем.
Гальваноспециальная обработка металлических кружев — использование декоративного слоя из серебра или золота или окисления.
Технологии -> пекарь
пекарь
Покрытие баком
Медные покрытия обычно не используются как самостоятельное покрытие для декоративных целей, а также для защиты стальных деталей от коррозии. Это связано с тем, что медь в атмосферных условиях легко окисляется, покрывается окислением.
Однако из-за хорошей адгезии осажденной меди к различным металлам медное покрытие используется в многослойных защитных и декоративных покрытиях в качестве промежуточных подошв, а также для защиты стальных деталей от газификации.
Для электроформования медные нанотрубки используются для изготовления металлических копий, рельефов основания, волноводов и матриц.
Медные электролиты делятся на кислотные и щелочные.
Кислотные электролиты используются сульфатными и борфтористоводородными. Наибольшее применение было доступно для сульфатных электролитов, характеризующихся их простым составом, стабильностью и высокой силой тока (до 100%).
Недостатком этих электролитов является невозможность непосредственного применения стальных и цинковых деталей для отделения медных контактов, которые плохо склеиваются с основным металлом.
Поэтому перед нанесением меди на стальные детали в кислотных электролитах они предварительно сохраняются в цианидных электролитах или наносимых тонких никелевых пластин. Недостатки сульфатных электролитов также являются их незначительной рассеивающей способностью и более грубыми: структура осаждения по сравнению с другими электролитами.
Электролиты щелочной меди покрывают цианидом, пирофосфатом и другими электролитами.
Цианид-медные электролиты обладают высокой дисперсионной способностью, мелкокристаллической структурой осаждения, возможностью непосредственных медных табличных объектов. К недостаткам относятся низкая плотность тока и нестабильность состава за счет карбонизации свободного цианида под воздействием углекислого газа в воздухе.
К недостаткам относятся низкая плотность тока и нестабильность состава за счет карбонизации свободного цианида под воздействием углекислого газа в воздухе.
Быстрое накопление меди.
Кроме того, цианидные электролиты характеризуются сниженной мощностью тока (не более 60-70%).
Будьте осторожны! Компания «LV-Engineering» не предоставляет услуги по гальванизации! Наша организация осуществляет проектирование гальванических изделий, производство гальванических ванных комнат и полипропиленовых линий, монтажные и пуско-наладочные работы в данном направлении.
Кислотные электролиты
Сульфат меди — 150-250 г / л
Никель-хлорид — 50-70 г / л
Температура = 18-25 ° C
Плотность тока составляет 1-4 А / дм2
Когда электролит смешивается со сжатым воздухом, плотность катодного потока может быть подключена к 6-8 А / дм2.
Для приготовления медносульфатного электролита растворите сульфат меди, процедите в рабочую пантеру и добавьте серную кислоту при непрерывном перемешивании.
Когда медные покрытия наносят из сульфатного электролита, аноды меди сначала растворяются с образованием двухвалентных ионов, которые осаждаются в виде металлической меди при выгрузке на катод.
Однако наряду с этими процессами существуют и другие, которые препятствуют нормальному течению электролиза. Анодное растворение возможно также при образовании одновалентных ионов, хотя и в меньшей степени.
В электролите, который удаляет медный металл, существует также химически обратимый процесс: Cu + Cu2 + = 2Cu +.
Накопление ионов иона иона в растворе в больших количествах приводит к тому, что реакция перемещается влево, а это означает, что к нему принадлежит медная медь.
Раствор также окисляет сульфаты меди из-за атмосферной серной кислоты N, особенно воздуха во время смешивания: Cu2SO4 + 1 / 2O2 + h3SO4 = 2CuSO4 + h3O.
На катоде в процессе отходящий двухвалентных и одновалентных ионов меди, но из-за того, что концентрация ионов одновалентной меди около 1000 раз ниже, чем концентрация ионов двухвалентной меди, катодная методом электроосаждения выглядит следующим образом: Cu 2+ + 2e = Cu. Токовый выход составляет 100%.
Токовый выход составляет 100%.
Присутствие сорбиновой кислоты требуется для получения плотного гладкого осадка в электролите.
Серная кислота выполняет множество функций: она значительно увеличивает электропроводность электролита; он уменьшает активность ионов меди, что способствует образованию мелких зерен; предотвращает гидролиз сульфата железа, что сопровождается образованием свободного осадка из оксида меди.
Ошибки электролита медно-сульфатного электролита и методы их устранения
| ошибка | Причина ошибки | средство |
| Грубая структура грубых осадков | Кислотный дефицит | Добавить кислоты |
| Высокая плотность тока | Уменьшить плотность тока | |
| Грубые сквозняки | Загрязнение электролита механическими примесями | Фильтровать электролит |
| Черные и коричневые линии на обложке | Наличие в электролитных примесях тяжелых металлов, мышьяка, сурьмы | Проверьте электролит с высоким содержанием примесей, замените электролит |
| Пористые, рыхлые отложения | Присутствие солей железа в электролите | |
| На крышке есть яркие блестящие линии, которые являются хрупкими | Присутствие органических примесей в электролите | Фильтруйте электролит и заряжайте его электричеством |
Борфторогидроэфир имеет немного большую мощность распыления, чем серная кислота.
Кроме того, флюсы высокой плотности могут использоваться в борфтористоводных электролитах. Состав электролита (г / л) и способ применения меди:
Гидрохлорид борфторида меди — 35-40 г / л
Борная кислота — 15-20 г / л
Соляная кислота — 15-20 г / л
Никель-хлорид — 50-70 г / л
Температура = 18-25 ° C
Плотность тока = до 10 А / дм2
Электролит смешивают со сжатым воздухом или механической мешалкой.
Свежую измельченную углеродную медь вводили небольшими порциями для приготовления скважинного углеводородного электролита в борфтористовородной кислоте.
Раствор углеродной меди готовят путем нагревания нагретого концентрированного раствора сульфата натрия в раствор сульфата меди путем смешивания. Полученный осадок декантируют, промывают и растворяют в борфтористой кислоте. К желаемому раствору добавляют свободную бороновую кислоту и борную кислоту до желаемого значения рН (1-1,5). Добавить воду на рабочую поверхность в ванне с электролитом.
Если перед вами стоит задача омеднения каких-либо деталей в автомобиле, то оказывается это вполне возможно сделать в домашних условиях. Для этого не потребуется особых знаний и умений, да и все материалы и реагенты вполне можно найти в магазинах или своих запасах. Что же, давайте посмотрим как можно сделать омеднение.
Для этого не потребуется особых знаний и умений, да и все материалы и реагенты вполне можно найти в магазинах или своих запасах. Что же, давайте посмотрим как можно сделать омеднение.
Когда делают омеднение и можно ли его использовать для коррозионного покрытия
Прежде чем рассказать о самом процессе, хотелось бы сказать пару слов о прагматичности такой операции.
Многие из автолюбителей не особо знакомых с химией сейчас скажут о необходимости омеднения всего чего попадется под руку, но мы вас предостерегаем от этого! Почему!? Да потому что все металлы между собой образуют гальваническую пару. Такая гальваническая пара образуется даже при попадании воды, а если средой будет еще и кислота, то процесс пойдет в разы быстрее.
Суть процесса в гальванической паре сводится к следующему. Более активный металл отдает свои электроны, а менее активный принимает. Вот так и образуется самая простая «батарейка» в которой протекает электрический ток.
Давайте теперь взглянем на стандартные электродные потенциалы:
— для меди Е0(Сu2+/Cu)=0,34В;
— для железа E0(Fe2+/Fe)=-0,44В.
В итоге получается не все так гладко.
Ведь в такой гальванической паре У железа электродный потенциал более активным. Опять же у меди электродный потенциал более положителен, чем у железа, поэтому она будет менее активна.
В итоге электроны потекут от железа к меди, что приведет к коррозии железа.
Все это мы рассказали к тому, что бездумно покрывать медью все что вам попадется под руку на машине не рекомендуется. Ведь в этом случае вы можете значительно сократить жизненный цикл многих железных деталей (крепеж, кузовные детали).
Гальваническое меднение
Не зря для сохранения железа применяют цинк, там ситуация с электродными потенциалами обратная.
Однако омеднение может применяться для декоративной отделки железа, если покрытие будет находиться в сухости.
Также медь может применяться в случаях, где необходимо обеспечить передачу электрического тока между контактами. Опять же надо следить за их чистотой.
Медь может применяться в условиях применения пар с незначительным трением скольжения. Все это в целом вполне жизнеспособные варианты. А значит и омеднение все же имеет шанс на его реализацию.
Все это в целом вполне жизнеспособные варианты. А значит и омеднение все же имеет шанс на его реализацию.
Тогда не будем более медлить, расскажем непосредственно о процессе омеднения.
Процесс омеднение деталей в домашних условиях (расчет слоя покрытия при определенном токе)
Омеднение происходит в растворе. По сути этот процесс обратный гальванической паре, то есть тому, о чем мы рассказывали в абзаце выше.
Для раствора нам понадобиться кислота, можно взять электролит используемых для аккумуляторов. Воду и медный купорос.
Для раствора берется 100 мл электролита на 20 мл воды и добавляется 20 г медного купороса.
В качестве донора меди можно взять медные пластинки или обычный медный провод, предварительно очищенный от изоляции. Итак, именно в этот самый раствор и помещаем медь. При этом подключаем блок питания постоянного напряжения питания к меди (+) и к железу (-). Ток на блоке питания выставляем тот, при котором мы планируем за определенный период времени нанести определенный слой меди. (-7)
(-7)
* желаемое время, скажем 3 часа – 10800 секунд). Считаем…
I=8920*0,1*0,0001/0,0000066*10800=0,0892/0,07128=1,25 А
То есть за 3 часа при токе 1,25 А у нас будет покрытие в 0,1 мм на детали площадью 0,1 м3. Вот как-то так и считаем все аналогичные вариации.
А да, время от времени не забываем помешивать раствор, чтобы процесс шел равномерно.
После того как омеднение завершено, вытаскиваем детали из раствора и отмываем хорошо с щелочью, то есть с мылом.
Если есть каике-то заусенцы и отклонения от формы, то их вполне можно пройтись наждачной бумагой и заполировать.
Собственно вы теперь не меньше знаете, как производить омеднение поверхности.
Надо сказать, что по тому же принципу производится и оцинкование и хромирование… В итоге понимая принцип происходящего процесса можно перенести процесс покрытия поверхности и на другие металлы.
Состояние электрического тока растворов цианистого меди значительно отличается от тех, которые считаются наиболее благоприятными в кислотных растворах. Из-за того, что образуются сильные сложные ионы и очень низкая скорость диссоциации, активность ионов меди в цианидном растворе настолько мала, что потенциал около 1 В становится более отрицательным, чем раствор серной кислоты.
Из-за того, что образуются сильные сложные ионы и очень низкая скорость диссоциации, активность ионов меди в цианидном растворе настолько мала, что потенциал около 1 В становится более отрицательным, чем раствор серной кислоты.
Увеличивая плотность тока, катодный потенциал меди в цианидных электролитах, в отличие от кислоты, сильно изменяется в направлении электроотрицательных значений (рис.
84), который определяет условия кристаллизации и распределения металла на поверхности катода; С этой точки зрения условия в цианидных электролитах чрезвычайно благоприятны.
Но именно из-за потенциала катода быстро растет с плотностью тока, это не может быть существенно увеличено, в противном случае выходной ток металла может быть сведен к нулю.
Рис. 84. Кривые поляризации медных электролитов:
1-сульфатного электролита 1,5-n. CuSO4 + 1,5-n.
h3S04; 2-цианидный электролит композиции 0,25-n.
CuCN + 0,6-n. NaCN + 0,25-n. Na2C03; 3 — тот же электролит при 45 ° C; 4 представляет собой тот же электролит в присутствии Na2S2O3
Еще одно важное различие в кислотности цианидных электролитов следует рассматривать как значительные изменения в характеристиках меди в зависимости от концентрации свободного цианида, в то время как свободная серная кислота оказывает очень мало влияния на характеристики меди в кислотных электролитах.
Если в растворе, содержащем 9 г меди на литр в форме цианидной соли (0,1 м.
Гальванизация собственными руками дома: технологии и оборудование
CuCN) и 13 г / л KCN, медный потенциал -0,60 В, в присутствии 26 г / л KCN этот потенциал равен -0,964 В и в присутствии 65 г / л -1,169 В.
Катодная поляризация также сильно зависит от концентрации солей меди в электролите, в то время как кислотные электролиты оказывают незначительное влияние.
Анодный процесс в цианидных электролитах также сопровождается значительной поляризацией, размер которой в основном определяется содержанием свободного цианида.
Отсутствие цианидного анода неактивно до полного растворения их растворения. Таким образом, содержание свободного цианида оказывает диаметрально противоположное воздействие на процессы катодного и анодного; Сначала требуется минимальное содержание свободного цианида (катодная плотность тока может быть выше, чем ниже цианид в электролите), второй — по величине (анод пассивации начать с самой высокой плотностью тока, тем выше содержание цианида).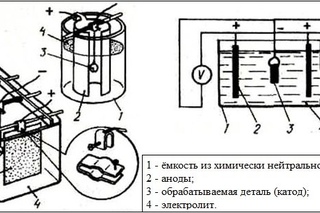
Это значительно ограничивает выбор концентрации цианида, который является основным компонентом электролита из соли меди.
Для большинства цианидов электролиты не могут полностью использовать методы, которые позволяют им использовать увеличенную плотность тока, такую как смешивание или значительное повышение температуры, по той причине, что эти процессы ускорили гидролиз цианида. Даже в состоянии покоя при комнатной температуре цианид электролита разрушается быстрее, чем кислота, что приводит к абсорбции углекислого газа из воздуха.
Электролиты из цианид-меди, нанесенные на катод, извлечение из одновалентных ионов, т. Е. При 1 Ач теоретически получают в два раза больше меди, чем в кислотных электролитах, где медь присутствует в виде двухвалентных ионов.
Тот факт, что цианистые электролитный баланс потенциал медь сильно отрицательная с более высоким потенциалом плотности тока переместился от электрических величин служат в качестве основы для суждения невозможности осаждения меди из цианистых электролитов при высоких плотностях тока (по заказу 10 А / дм 2) с теоретическим или вблизи теоретического выхода поток.
На самом деле это справедливо только для разбавленных цианидных электролитов, не страдают от перемешивания и нагрева. При определенных условиях медь может выделяться на электролитах с цианидным катодом, особенно при низком содержании свободного цианида в электролите при высоких температурах и при смешивании при достаточно высокой плотности тока и эффективности тока, близкой к теоретической.
Нанесение медного покрытия на алюминий
«Образование, алоха и развлечения… с 1989 года»
Сегодня вторник, 18.01.22, и ваши вопросы или ответы приветствуются.
Звоните прямо сейчас! (сайт без регистрации)
Текущий вопрос:
Учебник:(чтобы помочь читателям лучше понять вопросы и ответы)
Алюминий, в отличие от большинства металлов, является чрезвычайно «активным» металлом, который немедленно окисляется. То есть он мгновенно наращивает на себе тонкое покрытие из оксида алюминия, что делает нанесение гальванического покрытия на него затруднительным и ненадежным. Правильное гальванопокрытие выполняется на сыром металле, а не на оксидах.
Правильное гальванопокрытие выполняется на сыром металле, а не на оксидах.
Следовательно, после очистки, но перед гальванопокрытием, требуется промежуточный этап, который растворяет эти оксиды и заменяет алюминий на поверхности цинком (или, реже, оловом). Этот шаг называется «цинкованием» и включает в себя погружение алюминиевого изделия в высококонцентрированный, сильнощелочной раствор цинка, что вызывает процесс смещения/замещения.
Было обнаружено, что, по крайней мере, для определенных сплавов и условий лучшие результаты дает «двойное цинкование», т.е.е., проводят процесс цинкования, затем удаляют цинк азотной кислотой, затем проводят процесс цинкования во второй раз.
24 мая 2021 г. В. Уважаемые господа, я попытался покрыть внутреннюю часть полусферы алюминиевым сплавом на основе кремния. Я использовал вспомогательные аноды. Моим требованием было около 100 микрон медного слоя. Применяю щелочную очистку, травление, двойное цинкование, цианирование, затем кислотное меднение. В нижней половине моего куска появились волдыри. Подскажите, пожалуйста, как мне избавиться от этой проблемы.
В нижней половине моего куска появились волдыри. Подскажите, пожалуйста, как мне избавиться от этой проблемы.
Предыдущие тесно связанные вопросы и ответы, самые старые сначала:
1996 г.В. Я изготавливаю 6 дюймов в диаметре. алюминиевые зеркала и хотел бы покрыть их медью. Я никогда в жизни ничего не гальванизировал, но освежил знания электрохимии в университете. Я попробовал образец полированного алюминия с медным купоросом. [аффил. ссылка на информацию/продукт на Amazon] решение и зарядное устройство [аффил. ссылка на информацию / продукт на Amazon], но нарост был очень вязким и не прилипал к алюминиевой поверхности, отслаиваясь, когда я пытался отполировать его до гладкой поверхности.
1996 г.
А. Д-р Довиги:
Поверхность алюминиевых изделий практически мгновенно окисляется, поэтому поверхность не активна и не поддается гальваническому покрытию. Решение состоит в том, чтобы сначала оцинковать изделие, заменив алюминиевую поверхность на оцинкованную поверхность, на которую можно наносить покрытие. Даже в этом случае медь гораздо более благородна, чем цинк, и из раствора сульфата меди будет образовываться волокнистое и нелипкое погружение. Вам нужно будет цианировать медную пластину или пластину из пирофосфата меди, прежде чем делать кислотную медь.
Даже в этом случае медь гораздо более благородна, чем цинк, и из раствора сульфата меди будет образовываться волокнистое и нелипкое погружение. Вам нужно будет цианировать медную пластину или пластину из пирофосфата меди, прежде чем делать кислотную медь.
1996 г.
В. Дорогой Тед,
Спасибо за ответ и информацию. Я знаю, что золотая поверхность намного лучше отражает инфракрасные волны. Единственной причиной использования меди была попытка снизить затраты. Будучи стоматологом, я работал с золотой фольгой и рассматривал этот вариант покрытия готовой поверхности зеркальной заготовки, но снова столкнулся с проблемой не прилипания золотой фольги к алюминиевой поверхности. Теперь, когда вы объяснили, почему (образование покрытия из оксида алюминия), я также понимаю, почему это не удалось.
1996 г.
В. Спасибо за ваш ответ и информацию о попытке гальванического покрытия алюминия медью и о том, почему мне это не удалось. Я также пытался покрыть алюминиевую поверхность золотой фольгой, но она не прилипла к поверхности. Теперь я понимаю, что оксидное покрытие является источником проблемы.
Теперь я понимаю, что оксидное покрытие является источником проблемы.
Любые предложения о том, как решить эту проблему и покрыть отражающую поверхность моего алюминиевого зеркала золотой фольгой?
Спасибо
Обратите внимание, что это зеркало будет работать при высоких температурах.
А. Еще раз привет. Пожалуйста, проверьте, прав ли я, что яркое погружение, анодирование и окрашивание золотом обеспечат желаемую отражательную способность инфракрасного излучения. Нет смысла продолжать попытки изобрести процесс приклеивания золотой фольги или золотого покрытия к алюминию, если только хорошо разработанный и гораздо более дешевый, простой и надежный метод, который я описал, не может предложить то, что вам нужно. Удачи.
С уважением,
Тед Муни, ЧП
Стремление жить Алоха
отделка.
1998 г.
A. Нанесение покрытия на алюминий обычно требует стадии цинкования. Ваш поставщик или поставщики щеточных покрытий, указанные на сайте www. finishing.com/chemicals, могут предоставить цинкат. Фактический процесс заключается в очистке алюминия, травлении его едким раствором, обессмоливании кислотой, подходящей для конкретного сплава, цинковании, удалении цинката азотной кислотой, повторном цинковании, цианировании медной пластины, кислотной медной пластине, никелевой пластине (часто 2 или более слоев), затем золото или хром.
finishing.com/chemicals, могут предоставить цинкат. Фактический процесс заключается в очистке алюминия, травлении его едким раствором, обессмоливании кислотой, подходящей для конкретного сплава, цинковании, удалении цинката азотной кислотой, повторном цинковании, цианировании медной пластины, кислотной медной пластине, никелевой пластине (часто 2 или более слоев), затем золото или хром.
Я не знаю статей, в которых рассказывается, как проектировать системы щеточного покрытия, но
— Справочник по гальванике под редакцией Ларри Дерни посвящен проектированию систем покрытия резервуаров, а
— Рубинштейн Электрохимическая металлизация посвящен энциклопедия информации о щеточном покрытии.
1999 г.
В. Я работаю в компании, работающей с высокочастотными печатными платами в качестве излучателей электромагнитного поля. На этих платах очень мало точек пайки, поэтому я заламинировал пластиковые подложки алюминиевой фольгой вместо дорогой меди. Моя идея заключалась в том, чтобы покрыть медью толщиной 1-2 микрона после травления лишнего алюминия по бокам выводов платы.
Гравировальная мастерская, которая поддерживает наши исследования и разработки, изначально была уверена в перспективах реализации еще одного крупного проекта через некоторое время, но после трех недель экспериментов ничего мне не дала.
1999 г.
А. Уважаемый г-н Островский,
Спасибо за письмо.
Мне кажется, что вы хотите сделать дорожки монтажной платы из алюминия, и вы просто хотите покрыть «выводы» в точках пайки, используя какое-то меднение. Использование надежной системы активации с использованием очистителя металла, затем цинкования, как вы описываете как алюминиевый связующий материал, затем устойчивый к алюминию химический никель, затем медь с гальваническим покрытием, затем гальваническое олово должно обеспечить поверхность для пайки для ваших соединений.
Ванна с цианидом меди
2001 г. В. Привет! У меня есть пара вопросов о ванне с цианидом меди: при сравнении «стандартной» ванны с ванной Рошель низкой эффективности; какой из них «добрее» к слою цинкования. То есть какой из них наименее агрессивен к цинку? Если да, то у меня есть следующие вопросы: Какие возможные помехи/загрязнения могут оказать негативное влияние на ранее нанесенный иммерсионный слой цинкования? Другими словами, что может разрушить или растворить слой цинка, когда я погружу изделие в ванну для закалки меди?
То есть какой из них наименее агрессивен к цинку? Если да, то у меня есть следующие вопросы: Какие возможные помехи/загрязнения могут оказать негативное влияние на ранее нанесенный иммерсионный слой цинкования? Другими словами, что может разрушить или растворить слой цинка, когда я погружу изделие в ванну для закалки меди?
Если возможно, меня также интересует связанное с этим химическое объяснение.
2001
А. Привет Стефан,
Лучшим раствором меди для нанесения покрытия на цинкат являются следующие растворы меди:
Вариант № 1. Цианид меди 41 г/л Цианид натрия 56 г/л Соль сегнетовая 60 г/л Карбонат натрия (стиральная сода) [аффил. ссылка на информацию/продукт на Amazon] 30 г/л Диапазон pH 10-10,5 Свободный цианид 8,0-10,0 г/л Температура 45-60 °C. Ток 2-3 А/дм2
Вариант № 2. Цианид меди 26 г/л Цианид натрия 32 г/л Сегнетова соль 30 г/л Карбонат натрия 30 г/л Цианид свободный 1,5-3,0 г/л Температура 45-60 °С.Ток 2-3 А/дм2.
Вы также должны использовать предварительный контакт, когда наносите цинкование в электролитическом растворе.
Чтобы свести к минимуму усилия по поиску и предложить несколько точек зрения, мы объединили ранее отдельные темы на этой странице.Пожалуйста, извините за повторение, несоблюдение хронологического порядка или то, что может показаться читателям неуважительным к предыдущим ответам — этих других ответов могло не быть на странице в то время 🙂
2003
В. Я пытаюсь нанести медь на пеноалюминий, используя цианид меди, раствор цианида калия, КОН, сегнетовую соль и карбонат калия и платиновый противоэлектрод.
Я выполняю стандартную предварительную обработку алюминиевой подложки перед нанесением покрытия, и моя проблема заключается в том, что после нанесения покрытия (через один день) пена начинает приобретать черный/синий цвет.
Меднение алюминиевого велосипеда
2007 г.В. Привет,
Я хотел бы спросить, какой метод я должен использовать для создания медного покрытия на алюминии.
Я решил превратить свой гоночный велосипед в небольшой «арт-проект».
2007 г.
А.Гальваника — это больше промышленная наука, чем хобби, Михал, и неясно, какие у вас есть оборудование, подготовка и опыт. Но для нанесения медного покрытия на алюминий потребуется цинкование, за которым следует покрытие цианидом меди, а затем покрытие светлой кислотой. Наш «обязательный список книг» подробно раскроет каждую из этих тем.
Но я думаю, что вы должны иметь возможность более просто «покрасить» свой велосипед с помощью системы грунтовки, краски на основе меди и раствора для патинирования.
17 февраля 2013 г.
А. Привет, Венката. Алюминиевая шина обычно покрыта медью, потому что медь имеет лучшую поверхностную проводимость (поскольку алюминий быстро окисляется на воздухе, образуя на своей поверхности изолирующее покрытие из оксида алюминия). Но медное покрытие обычно недостаточно толстое, чтобы значительно изменить емкость шины по постоянному току. Например, если алюминиевая шина имеет проводимость 50-60% от проводимости медной шины эквивалентного размера, то после покрытия ее медью она все равно будет иметь проводимость 50-60% от проводимости медной шины.
Лучший состав для нанесения цианида меди на алюминий с двойным цинкованием
25 ноября 2014 г. — эта запись добавлена к этой теме редактором вместо создания дублирующей темы.В. Я работаю в небольшой гальванической мастерской и часто обрабатываю в основном декоративные алюминиевые детали, которые в конечном итоге покрываются золотом или платиной. Я использую очень простой цианид меди (50 г/л цианида меди, 90 г/л цианида кастрюли) после двойного цинкования и иногда сталкиваюсь с вздутием меди (и последующими отложениями).
сентябрь 2015 г.
Привет, Джон. Вы еще не представились (студент старшей школы, аспирант, опытный владелец гальванического цеха, любитель без опыта гальваники) или что вы на самом деле пытаетесь построить (должно ли анодирование оставаться на месте или его можно снять, один штук или тысяч и т. д.) … что оставляет меня в положении, когда я должен начать с самых основ, рискуя поговорить с кем-то, кто может знать об этом в 10 раз больше, чем я, поэтому я прошу прощения, если это так, но.
ноябрь 2015 г.
Привет Мохаммад.
10 марта 2018 г.
В. Уважаемый сэр,
Надеюсь, вы в порядке.
Я хотел бы нанести медное покрытие на алюминий, поэтому я попытался провести эксперимент, чтобы получить покрытие, но потерпел неудачу. Мой состав электролита CuSO4 200 г/л + 120 г/л серной кислоты;
Я поместил алюминиевый профиль M24 примерно (6 «* 2») и получил 18 В переменного тока. После анодирования в результате на поверхности алюминия грубо появляются коричневатые частицы. Пожалуйста, скажите мне, если кто-нибудь думает, что есть другие методы, которые могут улучшить его.
марта 2018 г.
А. Привет Камран. Я пытаюсь понять, что вы сказали, но я немного сбит с толку.
Во-первых, вы использовали слово «анодирование», но я думаю, что вы имели в виду «гальваническое покрытие», а не отдельный и другой процесс анодирования алюминия? Во-вторых, для гальваники требуется постоянное напряжение, а не переменное. В-третьих, 18 В — это слишком много; больше похоже на 3V было бы правильно. В-четвертых, перед нанесением покрытия алюминий должен быть подготовлен путем очистки, травления, удаления грязи и цинкования. В-пятых, на алюминии (фактически на цинкате) нельзя использовать ванну для гальванопокрытия медным купоросом.
В-четвертых, перед нанесением покрытия алюминий должен быть подготовлен путем очистки, травления, удаления грязи и цинкования. В-пятых, на алюминии (фактически на цинкате) нельзя использовать ванну для гальванопокрытия медным купоросом.
марта 2018 г.
А. Привет Камран. Демутирование — это шаг, который часто используется между травлением и анодированием (в зависимости от конкретного обрабатываемого алюминиевого сплава) для удаления легирующих материалов с поверхности, поскольку травление растворяет алюминий, но оставляет кремний, медь и другие легирующие материалы на поверхности. поверхность. Очевидно, вы пытаетесь гальванизировать медь на анодированную поверхность переменного тока. Цинкование, кажется, не имеет никакого отношения к вашему эксперименту, так что нет смысла его путать.
Я никогда не слышал о попытках нанесения гальванического покрытия на поверхность, анодированную серной кислотой, так что дело за вами. Откуда вы взяли идею этого процесса, какие статьи вы читали об этом (когда экспериментальные методы нанесения покрытий остаются только экспериментальными методами, обычно это происходит потому, что они плохо работали). Почему вы пытаетесь гальванизировать медь на алюминий таким странным способом, вместо того, чтобы использовать проверенные на производстве методы? Каково конечное использование этого алюминия с медным покрытием?
Почему вы пытаетесь гальванизировать медь на алюминий таким странным способом, вместо того, чтобы использовать проверенные на производстве методы? Каково конечное использование этого алюминия с медным покрытием?
С уважением,
Тед Муни, П.
12 марта 2018 г.
Hi Kamran
Анодирование создает оксидный слой на алюминии. Оксид алюминия не проводит электричество. Я очень удивлен, что у вас есть отложения меди. Предположительно, это связано с тем, что вы наносите медь сразу после анодирования и до того, как поры в оксидном слое запечатаны. Какой бы ни была причина, адгезия должна быть очень плохой.
Можете ли вы объяснить причину анодирования?
Если вы просто хотите нанести медное покрытие на алюминий, процесс цинкования является стандартной практикой и используется уже много лет.
13 марта 2018 г.
В. Сэр Джефф Смит и сэр Тед Муни, большое спасибо за ваши ответы. Я очень рад за ваши добрые ответы. Во-первых, я объясню, что я добиваюсь цвета торнадо на нашем алюминии.
1. «Откуда вы взяли идею этого процесса?». На самом деле у меня есть алюминиевый профиль другой компании, покрытый медью, поэтому я пробую его.
2. «Почему вы пытаетесь гальванизировать медь на алюминий таким странным способом, вместо того, чтобы использовать проверенные в производстве методы?» Потому что я успешно нанес олово на алюминий с помощью этого процесса; то я бы попробовал сделать меднение на алюминий.
3. «Каково конечное использование этого алюминия с медным покрытием?» При изготовлении дверных/оконных профилей.
4. «Какой бы ни была причина, адгезия должна быть очень плохой». При пропускании электричества в электролитах появляется разбрызгивание (светящиеся пузырьки), адгезия которых по моему требованию должна быть плохой.
5. «Вы можете объяснить причину анодирования?» На самом деле в моей компании сначала анодируется алюминиевый профиль, а затем покрывается оловом (кислотная ванна), поэтому я его анодировал.
Состав моего бака нейтрализатора 80 г/л h3SO4+ 50 г/л HNO3, это демутация или нет?
Pfizer Aluminium — Лахор, Пакистан
^
18 июля 2018 г.

А.Уважаемые,
Это очень интересное чтение, недавно я случайно задумался над напылением меди на алюминий. Я бы пошел по пути использования любой из новых щелочных ванн с органическими связующими/комплексообразователями, которые полностью не содержат цианидов.
Не буду вдаваться в подробности, так как существует множество конкурирующих конструкций (имею в виду составы и параметры использования), некоторые более экзотические, чем другие, начиная с ванн, очень похожих на классические кислотные или щелочные ванны, заканчивая ваннами с ионными жидкостями.
Как кто-то выше сказал: удаление всех следов оксида алюминия — самая нетривиальная задача, которую только можно себе представить, кто-то выше дошел до аэрации ванн с газом аргон, чтобы избавиться от всех мыслимых следов кислорода!! Это дорого.
Также дорого то, что было упомянуто выше и включало две или три ванны с азотной кислотой (фу!). Но тогда этот процесс работает.
Чтобы научиться наносить покрытия на смешанные подложки, такие как алюминиевые сплавы (непротравленные), и добиться НЕКОТОРОЙ адгезии, необходимо изучить некоторые или все химические процессы, которые используются в полупроводниковой промышленности для нанесения медных покрытий на кремний и подобные материалы. Это требует нетривиального понимания конкурирующих добавок и большого количества чтения (не так много, действительно после прочтения 100 полезных страниц из 1200 найденных у вас будет довольно хорошее понимание вовлеченных процессов), после чего вы получите представление как перейти к разработке собственного процесса (поскольку ванна, подложка, примеси, плотность тока и множество добавок по-разному взаимодействуют с различными сплавами).
Это требует нетривиального понимания конкурирующих добавок и большого количества чтения (не так много, действительно после прочтения 100 полезных страниц из 1200 найденных у вас будет довольно хорошее понимание вовлеченных процессов), после чего вы получите представление как перейти к разработке собственного процесса (поскольку ванна, подложка, примеси, плотность тока и множество добавок по-разному взаимодействуют с различными сплавами).
Ключевое слово здесь — дамасский процесс. Он может наносить покрытие и выравнивать отверстие шириной 10 нанометров, вплоть до 0.Глухие отверстия 15 мм (!!) Но добавки там конкурентоспособные; несоответствие, и вы сделали, не понимая, что делать.
В качестве альтернативы можно использовать аналогичный процесс химического осаждения меди, но он также очень дорог, не говоря уже о нестабильности, нагреве и ограниченном сроке службы ванны. Если вы в конечном итоге активируете поверхность SnCl2 и ионами палладия, это станет еще дороже.
Не думаю, что половина компаний, предлагающих меднение на окнах, используют меднение в прямом смысле этого слова, можно получить медный цвет на материал различными другими, гораздо более простыми способами. Многие специальные синтетические лаки фиксируются на анодированном алюминии, и они могут содержать медные чешуйки/порошок/пластинки и т. д. вместе с другими добавками, чтобы сохранить блеск меди. (не скажу, бвахаха) (…и есть точные пластиковые имитации меди…)
Многие специальные синтетические лаки фиксируются на анодированном алюминии, и они могут содержать медные чешуйки/порошок/пластинки и т. д. вместе с другими добавками, чтобы сохранить блеск меди. (не скажу, бвахаха) (…и есть точные пластиковые имитации меди…)
Но, честно говоря, я бы старался избегать опасных вещей, таких как азотная кислота и т. д., и поскольку меня интересуют более простые формы (цилиндры), я бы использовал механическую медную струйную обработку для подготовки алюминиевой поверхности или даже включил бы в нее медь.Если бы у вас были деньги, HVAF мог бы наплавить столько меди на алюминий, сколько вам нужно. Просто очистите, начистите и защитите его после этого.
И, чтобы добавить: ЛЮБОЙ ПЫТАЮЩИЙСЯ ПОКРЫТИЕМ АЛЮМИНИЙ ДОЛЖЕН ПОНИМАТЬ, ЧТО АЛЮМИНИЙ БЫСТРО РАЗРУШИТСЯ БЕЗ ОКСИДНОГО СЛОЯ.
Таким образом, попытка покрыть алюминий подобна попытке покрасить горящий дом. НО, если дом не горит, он покрыт тефлоном, и краска не держится.
Надеюсь аналогия разумна.
стр.S. Когда я думаю об этом: анодирование перед меднением действительно звучит как приглашение к дамасскому процессу, поскольку анодирование создаст сотовую структуру, в которой медь может быть осаждена в глубокие отверстия. Но тогда вы находитесь в области специалистов по полупроводникам, и ваш уровень понимания химии соединений кватерниевого азота, сероорганических соединений и ароматических колец… должен наверстать упущенное, если вы хотите обеспечить надежный процесс.
Дозирование добавок начинается с уровней ppm (частей на миллион), и лучше всего, если они рассчитаны в молярных концентрациях по отношению к другим ключевым компонентам гальванической ванны.Я видел фотографии (сделанные с помощью электронного микроскопа), на которых 0,35 промилле добавки делают одно, а 1,0 промилле — совсем другое. И если вы добавили 1 ppm какой-то другой добавки, она полностью нейтрализовала первую добавку.
Я упоминал, что плотность тока сильно изменила то, что происходило в ванне? Это тоже нужно контролировать, в отличие от анодирования, которому все равно.
Еще раз: необходимо хорошо контролировать плотность тока на квадратный дециметр, должна быть обеспечена достаточная площадь анода, должно быть обеспечено перемешивание ванны.
20 июля 2018 г.
A. Более того: с использованием процесса, аналогичного классической фотографии:
1) замочить медную соль или комплекс в поры свежего анодирования — он должен быть совместим с ванной для анодирования
2) слить, замочить в проявочной ванне (восстановитель для превращения соли меди в медь и растворимую соль или комплекс)
((альтернативно 2a) превращение соли меди в нерастворимый осадок, такой как CuO, посредством окислительно-восстановительной реакции, 2b) преобразование CuO в Cu))
3) выщелачивание или промывка растворимых продуктов достаточно далеко
4) нейтрализовать, пассивировать, запечатать, покрыть лаком и т.д.обычным образом.
Я попробовал вариант этого на образце щелочной комплексной ванны. При первом добавлении спиртового раствора метиленового синего, по-видимому, выпадал в осадок нанометровый черный CuO, через некоторое время вырастали дисперсные кристаллы, оптическая плотность раствора уменьшалась. Затем, капая в жидкость для полоскания рта, плавающие микрокристаллы, кажется, еще больше превращаются в металлический блеск, который на бумаге выглядит как медь красного цвета с очень приятным металлическим блеском и блеском.
Затем, капая в жидкость для полоскания рта, плавающие микрокристаллы, кажется, еще больше превращаются в металлический блеск, который на бумаге выглядит как медь красного цвета с очень приятным металлическим блеском и блеском.
20 июля 2018 г.
A. Еще 3 примечания:
>90% опубликованных новых (= инновационных) исследований по медному и никелированию и различным составам покрытых сплавов (таких как Ni-P-Cu, Ni-P-Sn и т. д.) от 2016, 2017 и новее.
Имитация меди поверх элоксированного алюминия лучше всего выполнять, используя свежие незапечатанные поры в оксиде, заполняя их частицами меди. Поскольку поры малы, необходимо использовать частицы особого размера. Растворитель: следует использовать сверхнизкую вязкость, такую как диметилкетон (=UN1090, =ацетон) или метанол.В ванне обязательно должен присутствовать медный пассиватор. Для меня проще обойтись легковоспламеняющимся растворителем в одной ванне, чем работать с набором из 13 опасных ванн. Можно попробовать распыление/смешивание под давлением для усиления пропитки или электрофоретического осаждения.
Я попробовал одну комплексную ванну и, о боже, нужно подумать, прежде чем смешивать ингредиенты, важен порядок. Во-вторых, комплексная ванна именно цвета метиленового синего, очень и очень глубокая. Вы не увидите солнце через 1 дюйм жидкости.
декабря 2020 г.
А. Привет, Кви. Это очень интересный вопрос не только в отношении двойного цинкования (которое много раз обсуждалось на этом сайте, в частности, как тема 4074) и в качестве средства для удаления шлама с медьсодержащих сплавов, но и потому, что азотная кислота и нитраты имеют множество других применений. в отделке металла, а также. Я надеюсь услышать некоторые хорошие предложения для вашей проблемы!
Причина запрета, вероятно, в том, что его можно использовать для изготовления взрывчатых веществ, приготовления метамфетамина и других плохих вещей.Для нас будут найдены более дорогие и более вредные для окружающей среды заменители, поскольку азотную кислоту становится все труднее достать. Но ирония, конечно, заключается в вековой иронии человеческого состояния: по мере того, как мы находим и разрабатываем эти заменители, а азотную кислоту становится все труднее найти, производители взрывчатых веществ и метамфетамины найдут свои более вредные для окружающей среды заменители по мере того, как Что ж 🙂 |
Удачи и С уважением,
Тед Муни, ЧП РЕТ
Стремление жить Алоха
отделка.
Finishing.com стал возможным благодаря …
этот текст заменяется на bannerText
Отказ от ответственности: На этих страницах невозможно полностью диагностировать проблему отделки или опасность операции. Вся представленная информация предназначена для общего ознакомления и не является профессиональным мнением или политикой работодателя автора. Интернет в значительной степени анонимен и непроверен; некоторые имена могут быть вымышленными, а некоторые рекомендации могут быть вредными.
Если вы ищете продукт или услугу, связанную с отделкой металлов, проверьте следующие каталоги:
О компании/Контакты — Политика конфиденциальности — ©1995-2022 Finishing. com, Пайн-Бич, Нью-Джерси, США
com, Пайн-Бич, Нью-Джерси, США
Медное покрытие | Металлургия для чайников
Гальванопокрытие — это процесс использования электрического тока для покрытия электропроводящего объекта тонким слоем металла. Меднение — это процесс, при котором слой меди наносится на покрываемый предмет с помощью электрического тока.
Медное покрытие
В зависимости от используемой системы комплексообразования коммерчески доступны три основных типа процессов:
- щелочная (несколько модификаций цианида и нецианида) комплексная ванна
- ванна с кислотным (сульфатным и фтороборатным) комплексом
- ванна с слабощелочным (пирофосфатным) комплексом
При более высоком токе на предмете, подлежащем покрытию, образуются пузырьки водорода, оставляя дефекты поверхности.Часто добавляют различные другие химические вещества для улучшения однородности и яркости покрытия. Без какой-либо добавки практически невозможно получить гладкую поверхность с покрытием. Эти добавки могут быть чем угодно, от средства для мытья посуды до запатентованных соединений.
Эти добавки могут быть чем угодно, от средства для мытья посуды до запатентованных соединений.
Меднение — это покрытие медным металлом другого материала, часто других металлов. Покрытие предназначено для повышения долговечности, прочности или визуальной привлекательности, а меднение часто используется для улучшения тепло- и электропроводности.Меднение чаще всего встречается в электропроводке и посуде.
Иногда в декоративных целях используется медное покрытие, придающее предметам медный вид. Однако меднение чаще используется для электрических проводов, так как медь очень хорошо проводит тепло. Кроме того, многие печатные платы покрыты медью.
Поскольку медь является исключительным проводником тепла, медное покрытие также популярно в кухонной посуде. Скорость, с которой медь нагревается, обеспечивает равномерный нагрев поверхности и, следовательно, более равномерное приготовление пищи.Профессиональные повара обычно использовали посуду из цельной меди, обычно облицованную сталью для повышения долговечности, но она дорогая и обычно не входит в бюджет повара-любителя. Покрытые кастрюли и сковороды обычно изготавливаются из алюминия или стали с медным покрытием. Эта посуда с гальваническим покрытием по-прежнему позволяет использовать преимущества нагрева меди без затрат на альтернативы из чистой меди.
Покрытые кастрюли и сковороды обычно изготавливаются из алюминия или стали с медным покрытием. Эта посуда с гальваническим покрытием по-прежнему позволяет использовать преимущества нагрева меди без затрат на альтернативы из чистой меди.
Химическая промышленность
- раствор электролита (200 г CuSO4 · 5h3O + 25,0 мл концентрированного раствора h3SO4 в количестве дистиллированной или деионизированной воды, достаточном для получения л.00 л раствора)*
- пенни до 1983 года выпуска
- уксус
- NaCl
Оборудование
- блок питания (6,0–9,0 В, 0,60–1,0 А)*
- соединительные провода с зажимами типа «крокодил»
- Медная проволока калибра 16-18
- Стакан на 250 мл
- картонный квадрат (сторона около 15 см)
- Амперметр (опция)
Процедура
- Налейте 200 мл раствора электролита в химический стакан.

- Прикрепите соединительные провода зажимами типа «крокодил» к клеммам источника питания.
- Очистите монеты смесью 3 г NaCl и 15 мл уксуса, промойте и высушите.
- Плотно оберните один конец 10-сантиметрового медного провода вокруг каждой монеты, оставив свободными 5–6 см проволоки.
- Массу каждой медной проволоки в сборе и запишите массу.
- Проденьте свободный конец каждого провода через картонный квадрат и поместите квадрат над химическим стаканом так, чтобы копеечные «электроды» были погружены в раствор электролита, как показано ниже.Примечание: два блока электродов не должны соприкасаться.
Утилизация
Пенни, используемые в этом эксперименте, не должны повторно использоваться в качестве валюты. Твердые вещества можно выбрасывать вместе с другими твердыми отходами. Раствор электролита следует хранить для повторного использования; если возникнет необходимость утилизировать раствор, его следует смыть в канализацию большим количеством воды.
Обсуждение
По мере того, как медь наносится на катод (отрицательный электрод), медь переходит в раствор на аноде (положительный электрод) в виде ионов меди (II), поддерживая постоянную концентрацию ионов меди (II) в растворе электролита.
катод: Cu2+(водн.) + 2 e- Cu(s)
анод: Cu(s) Cu2+(водн.) + 2 e-
Коммерческое гальваническое покрытие выполняется очень медленно, чтобы получить гладкое и ровное покрытие гальванического металла. Хотя этот эксперимент не позволяет получить покрытие коммерческого качества, он дает студентам возможность изучить химию важного коммерческого процесса. Этот общий метод также используется для очистки меди. Маленький катод из чистой меди используется с большим анодом из нечистой меди.При работе электролизера чистая медь переносится на катод. Перед выполнением этого эксперимента учащиеся должны быть ознакомлены с законом Фарадея. Из этого закона учащиеся заметят, что для получения одного моля меди из иона меди (II) требуется 2 x 96 485 кулонов заряда.
Если снять показания амперметра, количество кулонов, фактически прошедших через электролитическую ячейку, можно рассчитать по формуле: q = It, где q — заряд в кулонах, I — ток в амперах, t — сила тока. время в секундах.По количеству кулонов заряда, прошедшему через ячейку, учащиеся могут рассчитать теоретическое количество молей меди, которое должно было быть покрыто, и сравнить его с фактическим количеством нанесенных молей. Если предположить, что теоретический выход равен фактическому выходу, можно рассчитать атомную массу меди.
Если показания амперметра не снимаются, учащиеся могут сравнить изменения массы двух электродов и по количеству молей покрытой меди рассчитать количество кулонов заряда, прошедшего через элемент, и средний ток через элемент.Медь является активным металлом, поэтому ее трудно наносить на пассивированную поверхность, что затрудняет прямое нанесение покрытия на металлы на основе железа. Для таких поверхностей часто требуется никелевое базовое покрытие, чтобы медь прилипала к нему.
Гальваническое покрытие, наблюдаемое на уроках химии, часто получаемое с помощью ванны с монетами и сульфатом меди, на самом деле является осаждением, а не гальванопокрытием. Подвергание поверхности любому износу приводит к тому, что неприлипшие отложения удаляются. Работая в такой ванне в течение более длительного времени, часто можно увидеть зернистую текстуру осаждения, а не гладкую поверхность покрытия.Коммерческие производители гальванических покрытий часто используют раствор на основе цианида меди, чтобы обеспечить высокий уровень содержания меди в растворе. Эти растворы по своей природе опасны из-за высокотоксичной природы цианида.
Меднение часто наносится с помощью процесса, называемого гальванопокрытием. Гальваника достаточно проста, чтобы ее можно было сделать дома, но может быть опасной, поэтому не рекомендуется неопытным. Простые установки гальванического покрытия часто используются в школьных демонстрациях, но в качестве вещества для покрытия чаще всего используется никель, а не медь.
Вам также может понравиться
Случайные сообщения
- Явления переноса
В технике и физике изучение явлений переноса касается обмена массой, энергией или импульсом между … - Порошковая металлургия
из трех основных этапов обработки. … - Технологии штамповки и термической обработки
Существуют различные методы формовки стали в готовые изделия, включая горячую ковку, горячую и холодную прокатку, бесшовную… - Футуристические материалы
Некоторые метаматериалы имеют отрицательный показатель преломления, оптическое свойство, которое можно использовать для создания «суперлинз», которые … - Отпущенный ковкий чугун (ADI) , представляет собой тип ковкого чугуна, характеризующийся повышенной ударной вязкостью, пределом прочности при растяжении…
Отделка металла — покрытие — IVD
Отделка металла — покрытие — IVD — NDT – AAA Plating & Inspection, Inc.
COVID-19: AAA Plating & Inspection, Inc.остается открытым для бизнеса во время коронавируса.
Список услуг
Просмотр услуг, благодаря которым компания AAA Plating & Inspection, Inc. стала предпочтительным поставщиком для многих представителей отрасли.
aaaplating.com/wp-content/uploads/f35-military-plane-100×50.jpg» data-delay=»8000″ data-rotate=»0″ data-saveperformance=»off» data-title=»Slide» data-param1=»» data-param2=»» data-param3=»» data-param4=»» data-param5=»» data-param6=»» data-param7=»» data-param8=»» data-param9=»» data-param10=»» data-description=»»>Ионное осаждение из паровой фазы
AAA Plating & Inspection, Inc.
 является крупнейшим предприятием по производству вакуумных покрытий в мире
является крупнейшим предприятием по производству вакуумных покрытий в миреЗащита окружающей среды
AAA Plating & Inspection заботится об окружающей среде.
Высочайшие отраслевые стандарты
AAA Plating & Inspection, Inc. получила признание за нашу давнюю приверженность качеству предоставляемых нами услуг.
КАЧЕСТВО, ПОСЛЕДОВАТЕЛЬНОСТЬ, УСТОЙЧИВОСТЬ
Быть преданным чему-либо в наши дни считается достойным восхищения в обществе. Очень немногие компании могут способствовать самоотверженности, и все же это одна из самых очевидных ценностей AAA Plating and Inspection. Это основная ценность, которую мы распространяем на наших клиентов, наших сотрудников, нашу отрасль и нашу окружающую среду.
Это основная ценность, которую мы распространяем на наших клиентов, наших сотрудников, нашу отрасль и нашу окружающую среду.
Независимо от того, каким бизнесом вы занимаетесь, принцип сложной работы все равно существует! AAA Plating and Inspection, Inc. процветает благодаря этому. Мы предлагаем нашим клиентам явное преимущество работы с компанией, приверженной качеству, последовательности и устойчивости. Это мощный костяк нашей компании.
Наши технологические решения включают пять типов услуг по анодированию, кадмированию, пассивации и окраске.Кроме того, AAA Plating and Inspection предлагает неразрушающий контроль, ионное осаждение из паровой фазы (IVD) алюминия и вакуумный кадмий.
Мы удостоены многочисленных отраслевых наград и являемся активными членами Ассоциации отделки металлов Южной Калифорнии и Национальной ассоциации отделки поверхностей. Кроме того, AAA Plating and Inspection гордится признанием своей приверженности окружающей среде в нашем сообществе и по-прежнему привержена этим усилиям сегодня.
AAA Plating & Inspection, Inc. — крупнейшее предприятие по производству вакуумных покрытий в мире; на нашем объекте площадью 50 000 квадратных футов мы предлагаем различные процессы, перечисленные ниже.
АНОДИРОВАНИЕ
Хромовое анодирование, серное анодирование, твердое анодирование, химическая пленка, фосфорное анодирование, борно-серное анодирование…
NDT
Флуоресцентный и проникающий краситель, определение твердости по Роквеллу и магнитопорошковая дефектоскопия
ОЧИСТКА
Абразивная очистка, водное обезжиривание, очистка титана, блестящее погружение меди, струйная очистка стеклянными шариками. ..
..
ИСПЫТАНИЯ
Солевой туман, высокая влажность, погружение в воду, сульфат меди
КРАСКИ/ПОКРЫТИЯ
Бесхроматные грунтовки, эпоксидные грунтовки (с высоким сухим остатком и на водной основе), протравливающие грунтовки, твердая сухая пленочная смазка…
СПЕЦИАЛЬНЫЕ ПРОЦЕССЫ
IVD Алюминиевое покрытие, вакуумное кадмиевое покрытие, кадмиевая пластина и щетка Кадмий
ДРУГОЕ
Водородное охрупчивание, снятие напряжений до 650°F
Запрос котировки
Пожалуйста, заполните приведенную ниже форму запроса расценки, например, расценки.
Медное покрытие | Электроосажденная медь
Главная > Металлическое покрытие и отделка > Меднение Технология ENSпредлагает ряд вариантов меднения, каждый из которых подходит для различных материалов подложки. Химическое медное покрытие обычно добавляют к деталям и компонентам, изготовленным из инженерных пластиков или избранных металлических сплавов. Кислотные медные покрытия используются со сталью, нержавеющей сталью, инваром, коваром и подобными металлами.Покрытия из пирофосфата меди используются при гальванопластике — ENS может гальваноформировать более 0,060 дюйма при сохранении мелкозернистой структуры.
Медное покрытиеобеспечивает превосходную электропроводность и пластичность. Он идеально подходит для электронных и микроэлектронных приложений. Медные покрытия обычно наносят на алюминиевые и инженерные пластиковые подложки.
Без применения никеля
Если ваше приложение не требует НИКЕЛЯ, наши услуги по меднению — идеальное решение. Цианид меди часто используется на алюминиевых деталях, в которых указаны только медь и серебро (БЕЗ НИКЕЛЯ).
Цианид меди часто используется на алюминиевых деталях, в которых указаны только медь и серебро (БЕЗ НИКЕЛЯ).
Области применения для меднения
Многим нашим клиентам требуется диффузионное медное покрытие для использования в вакуумных устройствах. Мы подвергаем наши медные покрытия многократным диффузионным обжигам в инертной атмосфере, чтобы спекать медь с материалом подложки. После такой диффузии наши медные покрытия не будут высвобождаться в вакууме.
Кроме того, медь обычно используется в качестве подложки для серебра, золота и других процессов металлизации.Медные ответные планки часто используются для обеспечения равномерного и тщательного покрытия всех полостей в деталях сложной формы или сложной формы. За ними часто следует дополнительное меднение и/или окончательное серебряное покрытие.
Промышленные стандарты меднения
Наши медные покрытия соответствуют стандартам MIL-C-14550B, AMS-C-14550, ASTM B734 и AMS 2418. Постоянный контроль и частые испытания наших химических составов для меднения помогают нам поддерживать оптимальное качество.
Свяжитесь с ENS Technology сегодня
Если ваши детали и компоненты нуждаются в высококачественном медном покрытии, вам нужна технология ENS.Свяжитесь с нами сегодня, чтобы узнать больше или начать свой проект.
Гальванопокрытие – Химия LibreTexts
Гальванопокрытие – это процесс нанесения одного металла на другой путем гидролиза, чаще всего в декоративных целях или для предотвращения коррозии металла. Существуют также особые виды гальванического покрытия, такие как меднение, серебрение и хромирование. Гальваническое покрытие позволяет производителям использовать недорогие металлы, такие как сталь или цинк, для большей части продукта, а затем наносить различные металлы на внешнюю сторону, чтобы обеспечить внешний вид, защиту и другие свойства, необходимые для продукта.Поверхность может быть металлической или даже пластиковой.
Введение
Иногда отделка носит исключительно декоративный характер, например, продукты, которые мы используем в помещении или в сухой среде, где они вряд ли пострадают от коррозии. На эти типы продуктов обычно наносится тонкий слой золота или серебра, что делает их привлекательными для потребителя. Гальваническое покрытие широко используется в таких отраслях, как автомобилестроение, авиастроение, электроника, ювелирные изделия и игрушки. В общем процессе гальванического покрытия используется электролитическая ячейка, которая состоит из нанесения отрицательного заряда на металл и погружения его в раствор, содержащий соль металла (электролиты), которые содержат положительно заряженные ионы металла.Затем из-за отрицательного и положительного зарядов два металла притягиваются друг к другу.
На эти типы продуктов обычно наносится тонкий слой золота или серебра, что делает их привлекательными для потребителя. Гальваническое покрытие широко используется в таких отраслях, как автомобилестроение, авиастроение, электроника, ювелирные изделия и игрушки. В общем процессе гальванического покрытия используется электролитическая ячейка, которая состоит из нанесения отрицательного заряда на металл и погружения его в раствор, содержащий соль металла (электролиты), которые содержат положительно заряженные ионы металла.Затем из-за отрицательного и положительного зарядов два металла притягиваются друг к другу.
Цели гальваники:
- Внешний вид
- Защита
- Специальные свойства поверхности
- Технические или механические свойства
Фон
Катодом будет деталь, подлежащая покрытию, а анодом будет либо расходуемый анод, либо инертный анод, обычно платиновый или углеродный (форма графита).Иногда покрытие происходит на стеллажах или бочках для повышения эффективности при покрытии многих продуктов. Пожалуйста, обратитесь к электролизу для получения дополнительной информации. На рисунке ниже ионы Ag + притягиваются к поверхности ложки, и в конечном итоге она покрывается металлом. Процесс осуществляется с использованием серебра в качестве анода и винта в качестве катода. Электроны переходят от анода к катоду и претерпевают раствор, содержащий серебро.
Пожалуйста, обратитесь к электролизу для получения дополнительной информации. На рисунке ниже ионы Ag + притягиваются к поверхности ложки, и в конечном итоге она покрывается металлом. Процесс осуществляется с использованием серебра в качестве анода и винта в качестве катода. Электроны переходят от анода к катоду и претерпевают раствор, содержащий серебро.
Рисунок 1 : Нанесение серебра на ложку.
История гальваники
Гальваническое покрытие было впервые открыто Луиджи Бруньятелли в 1805 году благодаря использованию процесса электроосаждения для гальванического покрытия золота. Однако его открытие не было отмечено, так как его игнорировала Французская академия наук, а также Наполеон Бонапарт. Но спустя пару десятилетий Джону Райту удалось использовать цианистый калий в качестве электролита для золота и серебра. Он обнаружил, что цианид калия на самом деле является эффективным электролитом.Позже, в 1840 году, двоюродные братья Элкингтон использовали цианистый калий в качестве электролита и сумели создать реальный метод гальванического покрытия золота и серебра. Они получили патент на гальваническое покрытие, и этот метод получил широкое распространение по всему миру из Англии. Метод гальванического покрытия постепенно становился все более эффективным и совершенным за счет использования более экологичных формул и источников питания постоянного тока.
Они получили патент на гальваническое покрытие, и этот метод получил широкое распространение по всему миру из Англии. Метод гальванического покрытия постепенно становился все более эффективным и совершенным за счет использования более экологичных формул и источников питания постоянного тока.
Выбор электролитов
Существует множество различных металлов, которые можно использовать для гальванопокрытий, поэтому выбор правильного электролита важен для обеспечения качества гальванопокрытий.Некоторые электролиты представляют собой кислоты, основания, соли металлов или расплавленные соли. При выборе типа электролита следует помнить о таких вещах, как коррозия, сопротивление, яркость или отражательная способность, твердость, механическая прочность, пластичность и износостойкость.
Подготовка поверхности
Целью подготовки поверхности перед началом нанесения на нее другого металла является обеспечение ее чистоты и отсутствия загрязнений, которые могут помешать склеиванию. Загрязнение часто предотвращает осаждение и отсутствие адгезии.Обычно это делается в три этапа: очистка, обработка и ополаскивание. Очистка обычно заключается в использовании определенных растворителей, таких как щелочные очистители, вода или кислотные очистители, для удаления слоев масла с поверхности. Обработка включает модификацию поверхности, заключающуюся в упрочнении деталей и нанесении металлических слоев. Промывка приводит к получению конечного продукта и является последним штрихом гальванического покрытия. Два определенных метода подготовки поверхности — это физическая очистка и химическая очистка. Химическая очистка заключается в использовании растворителей, которые являются либо поверхностно-активными химическими веществами, либо химическими веществами, вступающими в реакцию с металлом/поверхностью.При физической очистке применяется механическая энергия для удаления загрязнений. Физическая очистка включает трение щеткой и ультразвуковое перемешивание.
Загрязнение часто предотвращает осаждение и отсутствие адгезии.Обычно это делается в три этапа: очистка, обработка и ополаскивание. Очистка обычно заключается в использовании определенных растворителей, таких как щелочные очистители, вода или кислотные очистители, для удаления слоев масла с поверхности. Обработка включает модификацию поверхности, заключающуюся в упрочнении деталей и нанесении металлических слоев. Промывка приводит к получению конечного продукта и является последним штрихом гальванического покрытия. Два определенных метода подготовки поверхности — это физическая очистка и химическая очистка. Химическая очистка заключается в использовании растворителей, которые являются либо поверхностно-активными химическими веществами, либо химическими веществами, вступающими в реакцию с металлом/поверхностью.При физической очистке применяется механическая энергия для удаления загрязнений. Физическая очистка включает трение щеткой и ультразвуковое перемешивание.
Типы гальваники
Существуют различные процессы, с помощью которых люди могут гальванизировать металлы, такие как массовая гальваника (также гальваническая гальваника), гальваническая гальваника, непрерывное гальванопокрытие и гальваническое покрытие. Каждый процесс имеет свой собственный набор процедур, которые позволяют получить идеальное покрытие.
Каждый процесс имеет свой собственный набор процедур, которые позволяют получить идеальное покрытие.
| Массовое покрытие | Не подходит для деталей с деталями, так как не защищает от царапин и запутывания.Тем не менее, этот процесс эффективно размещает большое количество объектов. |
|---|---|
| Покрытие стойки | Дороже, чем массовое покрытие, но эффективно как для крупных, так и для хрупких деталей. Часто имеет детали, погруженные в растворы со «стойками». |
| Непрерывное покрытие | Такие детали, как провода и трубки, постоянно проходят через аноды с определенной скоростью. Этот процесс немного дешевле. |
| Линейное покрытие | Дешевле, так как используется меньше химикатов, а для покрытия деталей используется производственная линия. |
Покрытие металлов
Большинство гальванических покрытий можно разделить на следующие категории:
| Жертвенное покрытие | Декоративное покрытие | Функциональные покрытия | Мелкие металлы | Необычное металлическое покрытие | Покрытия из сплава |
|---|---|---|---|---|---|
| используется в основном для защиты.Металл, используемый для покрытия, расходуется в реакции. Общие металлы включают: цинк и кадмий (в настоящее время запрещены во многих странах). | используется в основном для привлекательности и привлекательности. Общие металлы включают: медь, никель, хром, цинк и олово. Общие металлы включают: медь, никель, хром, цинк и олово. | — это покрытия, сделанные в зависимости от необходимости и функциональности металла. Обычные металлы включают: золото, серебро, платину, олово, свинец, рутений, родий, палладий, осмий и иридий. | обычно представляют собой железо, кобальт и индий, потому что на них легко наносить покрытие, но они редко используются для покрытия. | — это металлы, которые еще реже используются для гальванического покрытия, чем второстепенные металлы. К ним относятся: As, Sb, Bi, Mn, Re, Al, Zr, Ti, Hf, V, Nb, Ta, W и Mo. | Сплав – это вещество, обладающее металлическими свойствами и состоящее из двух или более элементов. Эти покрытия изготавливаются путем нанесения двух металлов в одну и ту же ячейку. Общие комбинации включают: золото-медь-кадмий, цинк-кобальт, цинк-железо, цинк-никель, латунь (сплав меди и цинка), бронза (медь-олово), олово-цинк, олово-никель и олово-цинк. кобальт. кобальт. |
Каталожные номера
- Канани, Н. Гальваника: основные принципы, процессы и практика; Передовые технологии Elsevier: Оксфорд, Великобритания, 2004. .
- Ловенхайм, Фридрих Адольф. Современная гальваника . 3-е изд. Нью-Йорк, штат Нью-Йорк: J. Wiley and Sons, 1974. .
- Блюм, Уильям и Джордж Б. Хогабум. Принципы гальваники и гальванопластики (электротипирование) . 3-е изд. Нью-Йорк, Нью-Йорк: McGraw-Hill Book Company Inc., 1949.Распечатать.
- Петруччи, Ральф Х., Харвуд, Уильям С., Херринг, Ф.Г., и Мадура Джеффри Д. Общая химия: принципы и современные приложения. 9-е изд. Река Аппер-Сэдл: Pearson Education, Inc., 2007. .
Проблемы
- Каковы цели гальваники?
- Как работает гальваника?
- Почему важно подготовить поверхность перед началом гальванического покрытия?
- Какие бывают виды гальваники?
- Какие разные металлы можно использовать? (имя 5)
Ответы
- Обычно гальваническое покрытие используется либо в декоративных, либо в функциональных целях, а также для предотвращения коррозии металла.

- Гальванические работы через электролизер с катодом и анодом. Катод — это металл, который необходимо покрыть.
- Важно подготовить поверхность перед началом процедуры, так как иногда на поверхности есть загрязнения, которые могут привести к плохим результатам гальванического покрытия.
- Существуют различные типы гальваники: массовая гальваника (также гальваническая гальваника), гальваническая гальваника, непрерывное гальванопокрытие и гальваническое покрытие.
- Пять металлов, которые можно использовать в гальванике: цинк, кобальт, железо, олово и платина
Авторы и авторство
- Вайшали Миттал (Калифорнийский университет в Дэвисе)
Гальваника и анодирование
Гальваническое покрытие
Гальванопокрытие — это процесс, в котором используется электрический ток для восстановления растворенных катионов металлов (положительно заряженных ионов), чтобы они могли образовывать тонкое когерентное покрытие на электроде. Процесс начинается с опускания металлического предмета в раствор электролита с растворенными ионами другого типа металла. Как только продукт погружен в воду, электрический ток проходит как через раствор, так и через объект, который образует связь. Возникающий в результате электрический заряд заставляет ионы гальванического раствора прилипать к участкам поверхности металлической детали. Чем дольше объект находится в растворе, тем толще становится покрытие.
Процесс начинается с опускания металлического предмета в раствор электролита с растворенными ионами другого типа металла. Как только продукт погружен в воду, электрический ток проходит как через раствор, так и через объект, который образует связь. Возникающий в результате электрический заряд заставляет ионы гальванического раствора прилипать к участкам поверхности металлической детали. Чем дольше объект находится в растворе, тем толще становится покрытие.
Преимущества гальванического покрытия
Гальваника может быть выполнена для различных целей, в т.ч.
- Коррозионная стойкость — Подверженное коррозии вещество, такое как железо, часто может быть покрыто слоем неагрессивного материала, такого как цинк или никель, таким образом образуя защитный слой.
- Теплостойкость — Металлы с высокой термостойкостью выгодны для определенных отраслей, таких как авиация или автомобили. Эти металлы могут выдерживать более высокие температуры, которые часто связаны с самолетами, автомобилями и грузовиками.
- Механическая износостойкость – Когда более мягкий и ковкий металл покрывается другим материалом, он часто образует более устойчивый к повреждениям продукт.Эти продукты лучше приспособлены для борьбы с возможными повреждениями.
- Декоративные или декоративные цели – Гальваническое покрытие обычно дает более блестящий и блестящий продукт на матовой поверхности. По этой причине многие розничные продавцы используют гальваническое покрытие для товаров для дома.
- Экономичность- Изделия могут быть изготовлены из менее дорогого металла и покрыты более дорогим металлом, например золотом или серебром. Это может быть более экономичным вариантом.
- Проводимость – Некоторые металлы обладают свойствами, позволяющими им передавать тепло или электричество.Проводящие металлы невероятно полезны в производстве электроники, авиационной, автомобильной и коммуникационной промышленности.
Гальваническое покрытие обычно используется в промышленности для изготовления электрических деталей или компонентов. Когда отрицательно заряженный металл прикладывается к положительно заряженному металлу, ионы притягиваются. Хотя гальваническое покрытие обычно используется для достижения одного из вышеуказанных преимуществ, его также можно использовать для уменьшения трения или защиты от истирания или радиации. От этого процесса выигрывают все отрасли промышленности, от авиации и автомобилестроения до связи и здравоохранения.
Типы промышленных покрытий:
Гальваника обычно классифицируется по типу металла, который используется для покрытия. Наиболее распространенные металлы включают медь, олово, цинк и никель, а также другие различные сплавы.
- Медь является отличным проводником электричества и по этой причине является наиболее распространенным выбором для производителей средств связи. Он используется во всем, от печатных плат и полупроводников до электронных деталей и компонентов.
- Олово относительно мягкое и податливое и доступно в изобилии, обычно это самый доступный вариант. Обеспечивает защиту от коррозии и матовое покрытие.
- Цинк — еще один недорогой металл, подобный олову, из-за его доступности в изобилии. Цинк обеспечивает непревзойденную защиту от коррозии и обычно используется для винтов, гаек и болтов.
- Никель обычно упрочняет поверхность подложки и повышает износостойкость.Никель — прочный и блестящий металл, и его часто используют в качестве базового покрытия для покрытия драгоценных металлов, таких как золото или серебро.
Анодирование
Найдите лучший цвет для вашего продукта.Анодирование — это процесс электролитической пассивации, используемый для увеличения толщины слоя естественного оксида на поверхности металлических деталей. Этот процесс изменяет поверхность металла посредством электрохимического процесса без изменения состава металла. Анодирование создает слой с гораздо более высокой устойчивостью к коррозии и истиранию.Анодирование – безопасный процесс, не наносящий вреда здоровью человека. Анодированное покрытие химически стабильно, нетоксично; и термостойкий до точки плавления алюминия (1221 градус по Фаренгейту)
Преимущества анодирования
Подобно гальванике, анодирование также имеет ряд преимуществ, в том числе:
- Коррозионная стойкость — Анодирование создает слой оксида алюминия, который защищает алюминий под ним, увеличивая срок службы.
- Механическая стойкость – При анодировании создается полная связь и адгезия с лежащим под ним алюминием.Это обеспечивает продуктам чрезвычайно долгий срок службы и долговечность. Для восстановления первоначального вида анодированной поверхности требуется небольшой уход.
- Декоративные или декоративные цели- Анодирование имеет покрытия, которые позволяют алюминию сохранять блестящую металлическую поверхность. Обычно это также устраняет цветовые вариации. Можно добавить прозрачное покрытие, придающее изделию блестящее качество.
- Стабильность цвета. Внешние анодированные покрытия обеспечивают хорошую устойчивость к ультрафиолетовым лучам, не скалываются и не отслаиваются.Эти покрытия можно легко повторить.
- Экономичность- Алюминий имеет недорогое финишное покрытие, а также низкие затраты на техническое обслуживание, что делает его выгодной долгосрочной инвестицией.
Профессиональные компании, такие как Asheville Metal Finishing, могут помочь вашему бизнесу найти лучший вариант для вашей продукции. Профессионал может помочь убедиться, что у вас не будет проблем с неравномерным покрытием, а также определить наиболее экономичный вариант для вашей продукции.Поскольку гальванопокрытие и анодирование — это наука, вы должны убедиться, что вы оставляете это на усмотрение профессионала, чтобы определить лучшее решение для вас.
Химия меднения. – Научные проекты
Что такое гальваника?
Гальваника – это один из видов отделки поверхности. Есть много других видов. Все видели и держали в руках гальванические предметы, даже если не знали об этом. Примеры включают кухонные и ванные смесители, недорогие украшения и отделку некоторых автомобилей.Есть тысячи примеров. На самом деле, несомненно, что почти каждый кусок металла, который вы когда-либо видели, прошел какой-то процесс обработки поверхности. Существует три основных причины для обработки поверхности: улучшение внешнего вида, замедление или предотвращение коррозии (ржавчины) и повышение прочности и износостойкости (в случае «инженерной» отделки). Объект может быть обработан по любой из этих причин или по всем из них.
Термин «гальваническое покрытие» означает покрытие предмета тонким слоем металла с использованием электричества.Чаще всего используются золото, серебро, хром, медь, никель, олово и цинк, но также используются и многие другие. Объект, подлежащий покрытию, обычно представляет собой другой металл, но может быть тем же металлом или неметаллом, например, пластиковая решетка для автомобиля.
Гальваническое покрытие обычно происходит в «резервуаре» с раствором, содержащим металл, наносимый на объект. Этот металл находится в растворенной форме, называемой ионами. Ион — это атом, который потерял или приобрел один или несколько электронов и, таким образом, стал электрически заряженным.Вы не можете видеть ионы, но раствор может иметь определенный цвет; например, раствор никеля обычно имеет изумрудно-зеленый цвет. Однако осажденный металл будет серого или серебристого цвета.
Когда некоторые металлические химические вещества растворяются в воде, атомы металлов этих химических веществ могут свободно перемещаться, но теряют один или несколько электронов (отрицательные заряды) и в результате приобретают положительный заряд. Покрываемый объект отрицательно заряжен и притягивает положительные ионы металла, которые затем покрывают покрываемый объект и возвращают потерянные электроны, чтобы снова стать металлом.
Знакомым примером этого процесса является часто проводимый эксперимент, в котором ключ покрывают медью. Ключ (называемый катодом) подключается к отрицательному полюсу батареи и помещается в раствор уксуса, слабой кислоты. Положительная клемма батареи соединена с куском меди (называемым анодом, а часто и просто медным проводом), который помещается в раствор. Кислота медленно растворяет проволоку, образуя ионы меди, которые затем притягиваются к ключу, восстанавливают свои потерянные электроны и снова превращаются в металлическую медь, но теперь в виде тонкого покрытия на ключе.Аккумулятор заставляет все это происходить и предотвращает повторное растворение осажденной меди.
Теперь посмотрите на иллюстрацию. Положительно заряженные ионы меди находятся в растворе в свободном состоянии, но их притягивает отрицательно заряженный ключ. Когда ионы контактируют с ключом, они восстанавливают свои потерянные электроны, превращаются в металлическую медь и прилипают к ключу, где бы они его ни касались. Это основной процесс гальваники, и все его формы работают одинаково.
Другие распространенные процессы окончательной обработки
Существует еще один процесс нанесения покрытия, открытый в 1946 г., который называется химическое покрытие.Он получил такое название, потому что работает без электричества; действие чисто химическое и проходит само по себе, как только началось.
Электрические и химические процессы — не единственные способы покрытия объекта. Другой важный процесс называется осаждением из паровой фазы или вакуумным покрытием. В этом процессе наносимый металл превращается в пар, который конденсируется на покрываемом объекте. С помощью этого процесса, который выполняется в вакуумной камере, можно получить множество красивых отделок.
Другим все более важным процессом отделки поверхности является порошковое покрытие. Это зависит от того, что противоположные заряды притягиваются, как и при гальванике. Покрываемый объект электрически заряжен и напылен неметаллическим порошком, который прилипает к нему. Затем объект пропускается через печь, где частицы порошка плавятся и сливаются, образуя гладкую поверхность. К изделиям, обычно покрываемым таким образом, относятся рамы газонокосилок, спортивный инвентарь, оборудование для игровых площадок, садовая мебель и внутренние части холодильников, стиральных и сушильных машин.
 Потому что в нем нет ненужных примесей, которые могут быть в садовом купоросе.
Потому что в нем нет ненужных примесей, которые могут быть в садовом купоросе. если уж и есть горячее желание подпаятся к алюминию во многих точках и нужен именно ПОС в качестве припоя то ни в коем случае медь в качестве подслоя применять нельзя. адгезии нет. радикально лучше нанести химникель из любого раствора химникелирования с но добавить 2-3 грамма на литр любого фторида ( натрия, калия, аммония) рН раствора 5.5-3.5
если уж и есть горячее желание подпаятся к алюминию во многих точках и нужен именно ПОС в качестве припоя то ни в коем случае медь в качестве подслоя применять нельзя. адгезии нет. радикально лучше нанести химникель из любого раствора химникелирования с но добавить 2-3 грамма на литр любого фторида ( натрия, калия, аммония) рН раствора 5.5-3.5


 Толщина покрытия будет зависеть от продолжительности процесса меднения. Таким образом, можно достичь меднения поверхности любого изделия слоем в 300 мкм и более.
Толщина покрытия будет зависеть от продолжительности процесса меднения. Таким образом, можно достичь меднения поверхности любого изделия слоем в 300 мкм и более.
 При этом нужно стараться не прикасаться щеточкой к заготовке, чтобы не замкнуть цепь.
При этом нужно стараться не прикасаться щеточкой к заготовке, чтобы не замкнуть цепь.

 Во время работы содержание меди понижается из-за недостаточной их растворимости.
Во время работы содержание меди понижается из-за недостаточной их растворимости.

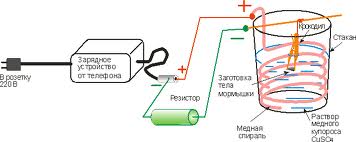

 Такая технология широко применяется при изготовлении сувенирной продукции, ювелирных изделий, а также барельефов и волноводов.
Такая технология широко применяется при изготовлении сувенирной продукции, ювелирных изделий, а также барельефов и волноводов.





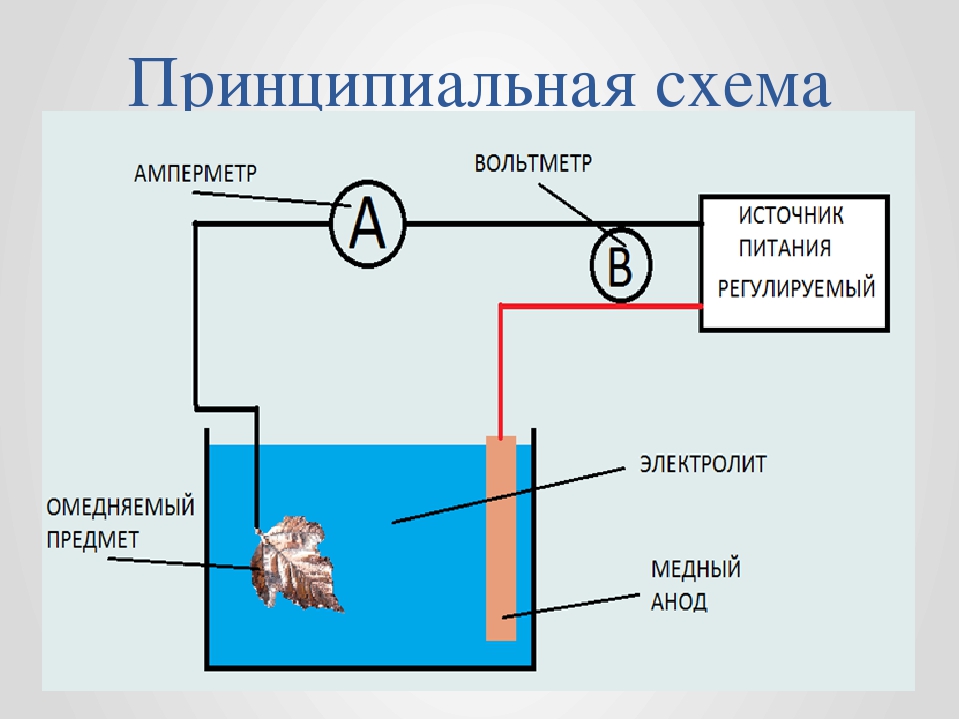 является крупнейшим предприятием по производству вакуумных покрытий в мире
является крупнейшим предприятием по производству вакуумных покрытий в мире