Саморазряд — цинковый электрод — Большая Энциклопедия Нефти и Газа, статья, страница 1
Саморазряд — цинковый электрод
Cтраница 1
Саморазряд цинкового электрода может вызываться действием на цинк различных примесей, содержащихся в электролите. Такими примесями могут быть ионы различных металлов, более электроположительных, чем цинк. Ионы этих металлов, разряжаясь на поверхности цинка, образуют короткозамкнутые пары, в которых цинк служит анодом. [1]
Саморазряд цинкового электрода ( коррозия цинка) усиливается в случае загрязнения цинка примесями с более низким перенапряжением выделения на них водорода, например железом. Примеси же металлов, обладающих большим перенапряжением выделения водорода, чем цинк, например ртути, уменьшают скорость растворения цинка. Последним обстоятельством пользуются в производстве элементов, амальгамируя цинковые электроды. [2]
Саморазряд цинкового электрода
 Примеси же металлов, обла — дающих большим перенапряжением выделения водорода, чем цинк, например ртути, уменьшают скорость растворения цинка. Последним обстоятельством пользуются в производстве элементов, амальгамируя цинковые электроды.
[3]
Примеси же металлов, обла — дающих большим перенапряжением выделения водорода, чем цинк, например ртути, уменьшают скорость растворения цинка. Последним обстоятельством пользуются в производстве элементов, амальгамируя цинковые электроды.
[3]Скорость саморазряда цинкового электрода заметно уменьшается после обработки его в подкисленном растворе сульфата ртути ( 5 г / л) вследствие повышения водородного перенапряжения. [4]
Вторым фактором, вызывающим саморазряд цинкового электрода, является кислород воздуха, соприкасающийся с влажной поверхностью цинка. [5]
Саморазряд серебряно-цинкового аккумулятора определяется саморазрядом цинкового электрода. Поэтому добавки в цинковый электрод металлов с высоким значением водородного перенапряжения, таких, как ртуть, свинец, олово, снижают, а с малым водородным перенапряжением, таких, как железо, повышают скорость растворения цинка. Вообще скорость растворения цинка той чистоты, которая требуется для аккумулятора, в щелочном растворе весьма незначительна. Скорость растворения реального цинкового электрода ввиду его очень большой поверхности, удельная величина которой равна примерно 0 5 м2 / г [56], существенно выше. Все же саморазряд серебряно-цинковых аккумуляторов сравнительно невелик.
[6]
Вообще скорость растворения цинка той чистоты, которая требуется для аккумулятора, в щелочном растворе весьма незначительна. Скорость растворения реального цинкового электрода ввиду его очень большой поверхности, удельная величина которой равна примерно 0 5 м2 / г [56], существенно выше. Все же саморазряд серебряно-цинковых аккумуляторов сравнительно невелик.
[6]
Саморазряд серебряно-цинкового аккумулятора определяется саморазрядом цинкового электрода. [7]
К недостаткам свинцово-цинкового элемента относят: чувствительность к температуре окружающей среды ( снижение температуры резко уменьшает разрядную емкость), обильное газовыделение при разряде из-за
Цинкование в домашних условиях своими руками
Метод цинкования – один из самых распространенных для создания надежной защиты для металла от коррозии. Он отличается простотой и дешевизной. Поэтому такой способ обработки можно выполнять в домашних условиях, для чего необходимо лишь соблюдать определенные условия.
Он отличается простотой и дешевизной. Поэтому такой способ обработки можно выполнять в домашних условиях, для чего необходимо лишь соблюдать определенные условия.
Цинкование как распространенный способ коррозийной защиты металлов
При создании качественных и долговечных металлических покрытий чаще всего применяют именно технологию цинкования. Это объясняется невысокой стоимостью расходных материалов и отличным результатом. Само цинкование происходит по простейшей технологии. Для ее осуществления не нужны дополнительные расходы и много усилий, что позволяет проводить подобную обработку в домашних условиях.
Холодное цинкование – защита металла от коррозии
Цинковое покрытие формируется в результате того, что цинк вступает в реакцию окисления с кислородом, находящимся в составе воздуха. В последующем на поверхности обрабатываемого металла образуется прочная защитная пленка, которая ограждает его от негативного воздействия внешней среды.
Цинк является более активным металлом, чем железо или сталь.
Проведение цинкования в домашних условиях
Технологический процесс цинкования подразумевает под собой осаждение катионов металла на аноде. Подобная химическая реакция протекает в ванне с электролитом при воздействии электрического тока.
Где найти электролит
В качестве электролита можно использовать любой раствор солей цинка. Самыми популярными и легкодоступными считаются хлорид цинка и соляная кислота. Также электролит с необходимыми свойствами можно получить методом травления цинка в серной кислоте. Эту реакцию следует проводить очень осторожно. Она сопровождается выделением большого количества тепловой энергии и взрывоопасного водорода.
Травление цинка в серной кислоте с выделением водорода и получением солей цинка
Как получить цинк
Для цинкования в домашних условиях необходимо подготовить цинк, который можно получить следующими способами:
- используя обычные солевые батарейки;
- плавкие предохранители времен Советского Союза;
- любые детали с цинковым покрытием;
- чистый металл, который можно найти в соответствующих магазинах, где продаются химические реактивы.

Схема получения цинка из батареек
Подготовка к выполнению процедуры
Для создания качественного металлического покрытия следует выполнить несколько подготовительных операций:
Процесс цинкования
- подготавливают гальваническую ванну. Ее роль может выполнять любая стеклянная или пластиковая тара;
- устанавливают штативы для анода и катода;
- электролит не должен содержать в составе нерастворенные кристаллы соли, для чего дополнительно вводят дистиллированную воду;
- роль анода выполняет цинковая пластина. Чем больше ее площадь, тем качественнее получится покрытие;
- к аноду присоединяется плюс от источника питания. Данных элементов при желании может быть несколько;
- к катоду присоединяется минус. На его поверхности будут осаждаться частицы цинка;
- катод должен быть очищен от ржавчины и любых загрязнений.
 Перед обработкой его дополнительно окунают в раствор кислоты;
Перед обработкой его дополнительно окунают в раствор кислоты; - катод должен находиться на одном расстоянии от анода, чтобы получилось равномерное покрытие со всех сторон;
- в качестве источника питания применяют любой аккумулятор или блок питания с постоянным током на выходе;
- чем больше сила тока и вольтаж, тем быстрее будет происходить реакция и тем рыхлее получится защитная пленка;
- при использовании автомобильного аккумулятора в цепь включают лампочку накаливания до 20 Вт для снижения силы тока.
Устройство для цинкования в домашних условиях
Технология создания цинковой пленки
Для создания качественного защитного покрытия на поверхности металла после проведенных подготовительных операций источник тока подключают к сети, а катод окунают в гальваническую ванну. Данный процесс должен проходить без бурного кипения. Если такое наблюдается, можно заподозрить слишком большую силу тока в системе.
Постепенно на поверхности катода будет формироваться металлическое покрытие. Чем дольше протекает этот процесс, тем больше будет толщина защитного слоя на металле.
Популярные методы
Существует много эффективных химических способов выполнения цинкования, каждый из которых имеет свои преимущества и недостатки. В любом случае созданное покрытие будет служить долго, если не подвергать его механическим воздействиям и правильно выбрать толщину защитного слоя с учетом особенностей эксплуатации изделий.
Особенности холодного цинкования
Горячий метод
Данный способ цинкования является одним из самых эффективных. После проведения подобной обработки удается создать надежное покрытие, которое надолго остается на поверхности металлических изделий. Недостатком горячего метода является его вредность для окружающей среды.
Для выполнения данной обработки необходимо придерживаться следующей технологии:
Этапы горячего цинкования
- подготовка. Поверхность металла обезжиривают, проводят травление;
- после выполнения подготовительных процедур деталь промывают и высушивают;
- изделий из металла опускают в емкость с цинковым раствором.
Такой метод цинкования не подходит для обработки больших по площади деталей и требует определенной подготовки, поиска подходящих емкостей.
Холодный метод
Данный метод обработки подразумевает окраску металлоизделий специальными смесями. Они содержат в составе цинк, что позволяет в кратчайшие сроки сформировать на поверхности надежное покрытие. Наносят такую краску обычным способом – валиком, кистью, краскопультом. Такой метод обработки идеален для деталей, которые невозможно покрыть защитным слоем обычным горячим цинкованием.
Наносят такую краску обычным способом – валиком, кистью, краскопультом. Такой метод обработки идеален для деталей, которые невозможно покрыть защитным слоем обычным горячим цинкованием.
Предназначение холодного цинкования
Гальваническое цинкование
Схема гальванического цинкования
Такое цинкование в домашних условиях проводится с применением электрохимических воздействий на металл. При его выполнении на поверхности металла образуется тонкая защитная пленка, которая эффективно защищает металл от внешнего негативного воздействия.
Для обработки изделие помещают в специальную емкость, где находится цинковая пластина. После этого подводится электричество. Именно оно переносит частицы цинка с пластин на поверхность обрабатываемых изделий.
Основным недостатком данного метода называют его дороговизну. Также в процессе обработки металла остаются опасные яды, которые требуют специальной утилизации.
Термодиффузионное цинкование
При выполнении термодиффузионного цинкования создается среда, которая характеризуется наличием высоких температурных показателей. Примерно при +2600°С цинк расщепляется на мелкие частицы, которые оседают на поверхности металлических изделий. Основным преимуществом данного метода цинкования является то, что в результате его выполнения образуется особенно толстый защитный слой.
Примерно при +2600°С цинк расщепляется на мелкие частицы, которые оседают на поверхности металлических изделий. Основным преимуществом данного метода цинкования является то, что в результате его выполнения образуется особенно толстый защитный слой.
Преимущества термодиффузионного цинкования
Процесс нанесения защитного покрытия на изделия из металла осуществляется в специальной камере закрытого типа. Вначале на поверхность детали наносится порошковый цинк, после чего она подвергается нагреву. Данная технология применяется исключительно в промышленных условиях. Дома ее использовать очень сложно, дорого и небезопасно.
Преимуществом термодиффузионного цинкования называют его безопасность для окружающей среды. Создаваемое покрытие имеет значительную толщину, что обеспечивает отличные защитные качества.
Газотермическое цинкование
Нанесение цинка осуществляется при помощи интенсивного газового потока. После выполнения подобной обработки поверхность обязательно окрашивают. Несмотря на особенности подобной технологии, она обеспечивает высокое качество и долгий срок службы обрабатываемых деталей.
Несмотря на особенности подобной технологии, она обеспечивает высокое качество и долгий срок службы обрабатываемых деталей.
Видео по теме: Цинкование металла в домашних условиях
Медно-цинковый гальванический элемент — Мегаобучалка
Медно-цинковый гальванический элемент состоит из медной и цинковой пластин, опущенных соответственно в растворы сульфатов меди и цинка, которые отделены друг от друга пористой перегородкой, пропускающей только анионы SO42-. При разомкнутой внешней электрической цепи на поверхности металлов устанавливаются равновесия:
Zn Zn2+ + 2e,
Сu Cu2+ + 2e.
|
Поскольку стандартный потенциал цинкового электрода более электроотрицателен, чем потенциал медного электрода, то при замыкании внешней цепи электроны будут переходить от цинка к меди. В результате равновесие на цинковом электроде сместится вправо, в сторону анодного процесса (окисления цинка):
| Zn – 2e → Zn2+. |
Пришедшие по внешней цепи электроны сместят равновесие на медном электроде в сторону катодного процесса (восстановления ионов Сu2+):
| Сu2+ +2е → Cu. |
Суммируя электродные реакции, получим:
| Zn + Cu2+ = Cu + Zn2+. |
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи (электрический ток), т.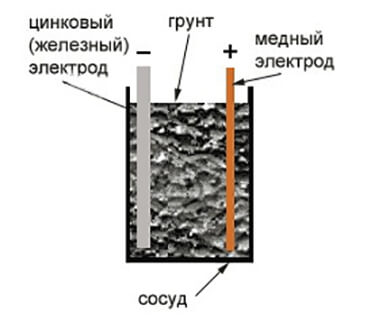 е. происходит превращение химической энергии в электрическую.
е. происходит превращение химической энергии в электрическую.
Используя уравнение Нернста, можно рассчитать ЭДС медно-цинкового элемента:
Еэ =Eк – Ea = ECu2+ / Cu – EZn2+ / Zn = E°Cu2+ / Cu – E°Zn2+ / Zn +
(0,059/2)·lg[c(Cu2+)/c(Zn2+)] = Е°э + (0,059/2)·lg[c(Cu2+)/c(Zn2+)],
где Еэ – ЭДС гальванического элемента в В, Е°э = (Е°к – Е°а) — стандартная ЭДС элемента в В, n = 2 – количество электронов, участвующих в катодном и анодом процессах.
Экспериментально определенная ЭДС всегда меньше вычисленной, поскольку при протекании тока в цепи происходит смещение потенциалов – катода в область более электроотрицательных значений, а анода — в область более положительных значений. Такое изменение электродных потенциалов называется поляризацией. Чтобы максимально уменьшить поляризацию необходимо измерять ЭДС гальванических элементов высокоомным вольтметром, чтобы ток в цепи был минимальным.
Такое изменение электродных потенциалов называется поляризацией. Чтобы максимально уменьшить поляризацию необходимо измерять ЭДС гальванических элементов высокоомным вольтметром, чтобы ток в цепи был минимальным.
Электролиз
Электролизом называются процессы, протекающие на электродах под действием постоянного электрического напряжения, подаваемого от внешнего источника. При этом происходит превращение электрической энергии в химическую. Анод подключается к положительному полюсу источника напряжения, а катод – к отрицательному. В производстве применяется электролиз как с растворимыми анодами (металлическими, кроме золота и платиновых металлов), так и с нерастворимыми, инертными анодами (графит, золото, платиновые металлы).
Зависимость между количествами прошедшего через электролит электричества и веществ, полученных или израсходованных на электродах определяется законами Фарадея:
1) масса вещества, испытавшего электрохимическое превращение, прямо пропорциональна количеству прошедшего через электролит электричества:
где m – масса вещества в граммах, Q – количество электричества в кулонах (Кл) (Q – заряд; Q = Iτ, где , I – ток в А, τ — время в с; А·с = Кл), k – электрохимический эквивалент, показывающий, сколько грамм вещества выделится или разложится при прохождении через электролит заряда в один кулон;
2) при одинаковых количествах электричества, прошедших через электролиты, массы веществ, прореагировавших или образовавшихся на электродах, относятся друг к другу как молярные массы их эквивалентов:
| m1/Mэ1 = m2/Mэ2 = … =mn/Mэn, |
где mi – массы веществ в граммах, Mэi – эквивалентные массы в г/моль. Для разложения или выделения одного моля эквивалентов вещества на электроде через него должен пройти один моль электронов, заряд которого равен постоянной Фарадея F:
Для разложения или выделения одного моля эквивалентов вещества на электроде через него должен пройти один моль электронов, заряд которого равен постоянной Фарадея F:
F = NAe = 6,02 · 1023 моль-1 · 1,6 · 10-19Кл = 96485Кл/моль.
Записывая первый закон Фарадея для одного моля эквивалентов вещества, получим
| K = Mэ/F. |
При электролизе расплавов индивидуальных солей в электролитах содержится по одному виду катионов и анионов, поэтому на катодах происходит восстановление катионов металлов, а на анодах — окисление анионов. Например, при электролизе расплава хлорида натрия на аноде протекает восстановление ионов Na+:
| Na++e → Na, |
а на аноде — окисление ионов Сl—:
2Cl— — 2e → Cl2.
|
Суммарный процесс можно записать следующим образом:
NaCl → Na + 1/2 С12.
При электролизе водных растворов электролитов возможно протекание нескольких электродных реакций, так как кроме катионов и анионов растворённых веществ в растворах присутствуют ионы Н+ и ОН—, образующиеся при диссоциации воды. На катодах в первую очередь восстанавливаются катионы металлов с наиболее положительными электродными потенциалами. Потенциал реакции восстановления ионов Н+, рассчитанный по формуле (38) принимает значения от -0,83 до 0 В (при изменении рН от 14 до 0). Катионы металлов, потенциал которых более положителен, чем потенциал водородного электрода (в ряду напряжений металлы расположенные правее водорода), в растворах восстанавливаются в первую очередь, а восстановления ионов Н+ не происходит. Таким образом восстанавливаются ионы Au3+, Hg2+, Ag+, Cu2+ и другие (Е которых >0).
Катионы металлов, потенциал которых отрицательнее потенциала выделения водорода (катионы щелочных, щелочно-земельных металлов и алюминия, Е которых <-0,83В) в водных растворах не восстанавливаются, т.к. на катоде происходит восстановление ионов Н+ .
Если в растворе содержатся катионы металлов, потенциал которых лежит в области значений потенциала восстановления ионов Н+ (ионы Sn2+, Pb2+, Ni2+, Cd2+, Zn2+ и других металлов, находящихся в ряду напряжений между алюминием и водородом), то на катоде одновременно происходит восстановление ионов Н+ и катионов металлов по реакции:
| Меn+ + nе → Ме. |
При протекании параллельных реакций на катоде часть количества электричества расходуется на осаждение металла, а другая часть — на восстановление ионов водорода. Доля от общего количества электричества, которая расходуется на выделение одного из веществ, называется выходом по току данного вещества. Выход по току металла рассчитывается по формуле:
Выход по току металла рассчитывается по формуле:
| BT(Me) = Q(Me)/Q, |
где Q – общее количество электричества, Кл; Q (Me) – количество электричества, затраченное на выделение металла, Кл. Сумма выходов по току металла и водорода составляет 1.
На анодах протекают реакции окисления восстановителей и в первую очередь идут реакции с растворимыми анодами по уравнению, обратному (49). При использовании нерастворимых анодов происходит окисление анионов, причем в первую очередь окисляются анионы, не содержащие кислород (анионы Вг—, I—, Cl—, S2—). Если в составе анионов содержится кислород (NO3—, SO42—, PO43— и др.), то на нерастворимых анодах окисляются ионы ОН— с выделением кислорода:
4ОН— — 4е → О2 + 2Н2О.
|
Коррозия металлов
Коррозия металлов — это разрушение металлов в результате их взаимодействия с окружающей средой. По механизмам протекания коррозионных процессов различают химическую и электрохимическую коррозию. Химическая коррозия протекает в газовых средах без конденсации влаги и при повышенных температурах (в печах), а также в растворах неэлектролитов. При этом происходит прямое гетерогенное взаимодействие металлов с окислителями сред.
При электрохимической коррозии происходит анодное окисление металлов и катодное восстановление окислителей на различных участках поверхности металлов, что сопровождается переходом электронов от анодных участков к катодным. Основными окислителями служат кислород и катионы водорода. При коррозии с выделением водорода (с водородной деполяризацией) на катодных участках протекает следующая реакция:
2Н+ + 2е → Н2.
|
Если окислителем является кислород (с кислородной деполяризацией), то катодный процесс в нейтральной и щелочной средах протекает по уравнению (1), а в кислой — по уравнению (2):
| (1) (2) | О2 + 2Н2О + 4е → 4ОН— , О2 + 4Н+ + 4е → 2Н2О. |
Коррозия возможна только при условии, что EMen+ / Me < Еок, т.к. процесс коррозии – это окисление металла (анодный процесс). Для определения возможности протекания коррозии нужно знать потенциал катодного процесса восстановления окислителя Еок. При коррозии с водородной деполяризацией Еок = Ен+/н рассчитывается по уравнению
ЕH+/H = -0,059рН.
Если коррозия протекает с кислородной деполяризацией, то Еок рассчитывается по уравнению Нернста для кислородного газового электрода (при 298К):
| Ео2/oH— = 1,23 – 0,059рН. |
Окислители играют двойную роль в процессах коррозии. С одной стороны, они могут восстанавливаться и этим ускорять коррозию металлов, а с другой стороны, могут вызывать явление пассивации некоторых металлов (хрома, титана, алюминия и др.) в результате образования защитных оксидных плёнок.
История и особенности серебряно-цинковых элементов питания
Серебряно-цинковые батарейки по своим техническим показателям превосходят аналогичные устройства других типов. Они обладают высокой энергоемкостью, отличаются постоянством напряжения, длительными сроками хранения и эксплуатации, отсутствием токсичности.
История создания серебряно-цинковых элементов питания
Первую электрохимическую батарейку с элементами из серебра и цинка гениальный итальянский ученый-физик Вольта создал в далеком 1800 году. Но изобретение не получило распространения, применения на практике. В электродах возникал сильный саморазряд, не позволяющий регенерировать, использовать создающийся ток.
Но изобретение не получило распространения, применения на практике. В электродах возникал сильный саморазряд, не позволяющий регенерировать, использовать создающийся ток.
Еще одна попытка применить батарейки на практике была осуществлена в сороковых годах 19 века. Ученые изучили свойства цинка и серебра в электрохимической системе. Оптимальные результаты дали ампульные элементы питания. В них была встроена ампула для хранения электролита, который заливался в устройство в момент применения.
Особенности конструкции серебряно-цинковых батареек
Гальванический элемент питания включает цинковый анод и катод из оксида серебра. В качестве электролита в конструкции используется щелочной раствор. Это могут быть гидроксиды калия (KOH) или натрия (NaOH).
В создании положительного электрода используется чашка, изготовленная из никелевой сетки. В нее запрессовывается оксид серебра. Конструкция устанавливается в корпус гальванического элемента питания, после чего запрессовывается.
Конструкция устанавливается в корпус гальванического элемента питания, после чего запрессовывается.
Отрицательный электрод изготавливается посредством запрессовки массы опилок из цинка в двухслойной армированной крышке. Ее наружная часть никелируется, а внутренняя подвергается лужению. Эти детали крышки соединяются при помощи точечной сварки. В целях надежной герметизации прокладывается кольцо из полипропилена или полиэтилена. Это позволяет получить цельную, прочную деталь батарейки.
В конструкции гальванического элемента анод и катод разделены сепараторами двух типов — целлофанового и бумажного. Они пропитываются цинкатной щелочной электролитной жидкостью.
В процессе разряда батарейки происходит двухступенчатое восстановление двухвалентной окиси серебра. В первом цикле проходит реакция, в результате которой получается одновалентный оксид серебра:
2AgO + 2e- + h3O = Ag2O + 2OH-
Нормативный потенциал процесса восстановления одновалентного оксида серебра +0,344В. Первая стадия поляризуется, происходит разряд, восстановление двухвалентного оксида серебра. Показатель его стандартного потенциала составляет +0,57В. Благодаря ступенчатому восстановлению окиси и металлизированного серебра сохраняется стабильное разрядное напряжение. Плотность тока составляет 1мА/см2.
Первая стадия поляризуется, происходит разряд, восстановление двухвалентного оксида серебра. Показатель его стандартного потенциала составляет +0,57В. Благодаря ступенчатому восстановлению окиси и металлизированного серебра сохраняется стабильное разрядное напряжение. Плотность тока составляет 1мА/см2.
Специфика работы серебряно-цинковых батареек
Рассмотреть принцип работы серебряно-цинковых батареек, оценить их преимущества можно на примере популярного щелочного элемента питания ЭСЦГД-0,2. Эти источники тока устанавливаются в электронные наручные часы, оборудованные светодиодной индикацией цифр.
Этим изделиям требуется миниатюрный источник тока, способный не оказывать существенного влияния на вес и размер часов, обеспечить разряд необходимой мощности. С такой задачей может справиться только серебряно-цинковый тип электрохимической схемы.
Батарейка ЭСЦГД-0,2 обладает минимальными габаритами. Ее высота 5,4мм, диаметр 11,6мм. В элементе питания содержатся катоды, изготовленные из окисей одновалентного и двухвалентного серебра с показателями 0,16А-ч и 0,25 А-ч соответственно. При токе 1 мА напряжение разряда составляет 1,56В.
Ее высота 5,4мм, диаметр 11,6мм. В элементе питания содержатся катоды, изготовленные из окисей одновалентного и двухвалентного серебра с показателями 0,16А-ч и 0,25 А-ч соответственно. При токе 1 мА напряжение разряда составляет 1,56В.
В обычном режиме работы часов разрядка элемента питания осуществляется в условиях плотности тока в диапазоне от 15 до 25 мкА. В период индикации цифр на табло часов батарейка разряжается в виде импульса. Плотность тока в данный момент составляет 50 мА 1 см2. Способность миниатюрного прибора разряжаться при таком высоком показателе плотности тока присуща только серебряно-цинковым элементам.
Правила эксплуатации кнопочных источников питания этого типа:
- использовать элементы рекомендуется при температуре от – 10°C до +55°C;
- хранить батарейки можно при температуре от — 40°C до +60°C;
- период хранения – до 4-х лет;
- срок эксплуатации источников тока – 2-4 года.

В мире есть несколько производителей серебряно-цинковых элементов питания. Основными брендами являются: Sony, RENATA, ENERGIZER, MAXELL, VARTA.
Виды серебряно-цинковых батареек
Выпускается несколько видов серебряно-цинковых элементов питания. Они различаются по размерам, мощности, емкости. Определить предназначение элемента можно по его маркировке. Изделия типа MD могут функционировать в любом режиме энергопотребления. Батарейки HD устанавливаются в устройствах с неравномерным, высоким уровнем потребления энергии. Модели LD предназначены для приборов, которые отличаются равномерным, низким энергопотреблением. Для точного определения маркировки создаются специальные таблицы.
Применение серебряно-цинковых батареек
Эти элементы не получили обширного применения из-за высокой цены на серебро. Однако они используются там, где необходимы компактные размеры и экологическая безопасность. Они обеспечивают питание:
Они обеспечивают питание:
- наручным часам;
- материнским платам ноутбуков и компьютеров;
- миниатюрным фонарикам;
- калькуляторам;
- брелкам;
- лазерным указкам;
- музыкальным открыткам и сувенирам, и др.
Саморазряд у элементов питания этого типа невысокий. Во время разрядов большими токами остается постоянное напряжение. Показатель отдачи тока у них близок к 100%, энергетическая отдача составляет примерно 85%. Благодаря этим показателям до появления литиевых источников серебряно-цинковые батарейки широко использовались в военной, авиационной, космической технике.
Преимущества и недостатки батареек
Преимуществ у серебряно-цинковых элементов питания много. Основные достоинства устройств следующие:
- высокая устойчивость к внешним воздействиям;
- максимальные показатели удельной энергии;
- стойкость к высоким разрядным токам;
- стабильные показатели напряжения при разряде;
- невысокие параметры саморазряда, не превышающие 15% общей емкости за 1 месяц;
- удобная эксплуатация, установка;
- производство батарей не причиняет вреда окружающей среде, является экологически безопасным.

К недостаткам устройств этого типа можно отнести стоимость. Цена на серебряно-цинковые элементы питания намного выше, чем на аналогичные батарейки других видов.
Более широкое распространение получили аккумуляторы данного типа.
Небольшой экскурс в историю серебряно-цинковых аккумуляторных батарей
Прошло почти сто лет после открытия Вольта, прежде чем появилась идея создания аккумулятора из цинковых и серебряных электродов. Ее высказывал Юнгнер, являющийся автором никеле-кадмиевых батарей. Но в ту пору это предложение не было реализовано.
Работой над созданием серебряно-цинкового аккумулятора занялся французский физик Андре. Первый образец появился лишь после 20 лет напряженного труда. Однако у этого новаторского прибора, представленного ученым в 1943 году, был существенный недостаток. Электрод из цинка, установленный в батарее, растворялся, не позволяя эффективно использовать аккумулятор. Через пять лет Андре удалось усовершенствовать свое изобретение. Он нашел способ создания батареи, в которой цинковые электроды не были растворимыми.
Через пять лет Андре удалось усовершенствовать свое изобретение. Он нашел способ создания батареи, в которой цинковые электроды не были растворимыми.
Отличные технические показатели аккумуляторов обеспечивают им перспективность, расширение области применения. Ученые всего мира и сегодня ведут работы по совершенствованию этих конструкций.
Особенности конструкции серебряно-цинковых аккумуляторных батарей
Рабочие элементы аккумулятора расположены в полупрозрачной пластиковой емкости. В роли анода выступает пластина, изготовленная из оксида серебра. Катодом батареи являются пластины, созданные из окиси цинка и цинкового порошка. Условия для аккумулирования зарядов создает электролитная среда. Это едкий калий, растворенный в воде в определенной концентрации.
Серебряный положительный электрод требуется защитить от активной щелочной среды. Для этого пластина анода помещается в конверт, созданный из прочного лозного материала, не пропускающего электролит.
Катоды заключены в упаковку из целлюлозных волокон. Ее структура обеспечивает проникновение раствора едкого калия. Под его воздействием сепаратор разбухает, не позволяя цинковой отрицательной пластине оплывать. Он надежно защищает катод от проникновения серебряных частиц.
В этих типах аккумуляторов нет необходимости устанавливать дополнительные решетки. Пластины плотно прилегают друг к другу, стоят непосредственно на дне корпуса. Они обладают высокой прочностью.
Специфика структуры, материалов аккумуляторной батареи:
- исключает риск появления коротких замыканий;
- обеспечивает оптимальную площадь взаимодействия раствора электролита с электродами, высокую эффективность;
- устойчивость к механическим воздействиям извне, вибрации.
В этих устройствах используется небольшой объем электролита, что дает возможность придавать прибору любое нужное положение. Исключить вытекание раствора едкого калия позволяет плотная пробка.
Исключить вытекание раствора едкого калия позволяет плотная пробка.
Свойства аккумуляторов
Серебряно-цинковые аккумуляторы могут не терять своих свойств даже при отсутствии электролита. Восстановление рабочего состояния не требует существенных хлопот. Необходимо:
- внимательно осмотреть элементы устройства, убедиться, что отсутствуют ржавчина и повреждения, не произошло короткое замыкание;
- влить в емкость электролит, для чего приготовить водный раствор едкого калия, имеющего плотность 1,4 г/см3;
- выполнить формировочные циклы заряда-разряда, сделать контрольный заряд, а затем рабочий.
Для ускорения процесса пропитки электролитов аккумулятор без крышек на заливочных отверстиях устанавливается в барокамеру. В процесс формирования включаются два полноценных цикла зарядки и разрядки. Полнота может контролироваться определением напряжения или временем, требуемым для полной зарядки. По нормативу напряжение должно быть около 2 В, разряжать батарею следует до показателя примерно 0,6-1,2 В.
По нормативу напряжение должно быть около 2 В, разряжать батарею следует до показателя примерно 0,6-1,2 В.
В процессе эксплуатации источника тока необходимо проверять уровень электролита в емкости, так как для его работы анод и катод должны быть залиты. На корпусе аккумуляторной батареи имеются специальные отметки, благодаря которым несложно определить максимальный и минимальный уровень жидкости.
Благоприятной температурой для хранения этих источников тока является 6-10°C тепла. В условии отрицательных температур снижается напряжение в стадии разряда, емкость. Поэтому при необходимости использовать источник тока в морозы нужно обеспечить его обогрев.
Область использования серебряно-цинковых аккумуляторных батарей
Сфера применения аккумуляторов обусловлена их основными параметрами. Они незаменимы в устройствах, где требуется эффективный, компактный источник тока с небольшой массой. Главными потребителями этих типов АКБ являются следующие области деятельности:
Главными потребителями этих типов АКБ являются следующие области деятельности:
- военная,
- авиационная,
- космическая,
- геофизическая,
- морская,
- научная.
Этими аккумуляторами оснащаются военные ракеты и морские торпеды, самолеты и вертолеты, морские суда дальнего плавания, космические устройства. Источники тока устанавливаются в геологическое оборудование, высокоточную вычислительную технику и т.д.
Обширную область применения аккумуляторных батарей обеспечивает большой модельный ряд устройств. Модели отличаются по размерам, техническим показателям.
Марка АКБ | Масса в граммах | Емкость, А*ч | Сила тока при |
СЦ-0,5 | 24 | 0,85 | 2 |
СЦ-1,5 | 35 | 1,8 | 3,5 |
СЦ-3 | 95 | 4,5 | 35 |
СЦ-5 | 160 | 7,5 | 60 |
СЦ-12 | 195 | 14 | 80 |
СЦ-15 | 245 | 16,5 | 95 |
СЦ-18 | 300 | 20 | 120 |
СЦ-25 | 470 | 27 | 150 |
СЦ-40 | 720 | 45 | 180 |
СЦ-45 | 760 | 50 | 200 |
СЦ-50 | 840 | 55 | 250 |
СЦ-70 | 1350 | 80 | 400 |
СЦ-100 | 1600 | 100 | 600 |
СЦ-120 | 1900 | 130 | 650 |
Большой ассортимент серебряно-цинковых аккумуляторов позволяет оптимально подобрать устройство с учетом специфики оборудования, в котором он будет установлен. {2 +} \) из раствора \ (\ color {blue} {\ textbf {синий сульфат меди (II)}} \) были восстановлены (получили электроны ) до металлической меди, которая затем была нанесена в виде слоя на твердый цинк.{2 +} \)) получают два электрона и осаждаются в виде твердой меди.
{2 +} \) из раствора \ (\ color {blue} {\ textbf {синий сульфат меди (II)}} \) были восстановлены (получили электроны ) до металлической меди, которая затем была нанесена в виде слоя на твердый цинк.{2 +} \)) получают два электрона и осаждаются в виде твердой меди.
(Фото benjah-bmm27 и Jurii в Википедии)
Помните, что когда вы проводили этот эксперимент, температура реакции повысилась (он был экзотермическим). Экзотермическая реакция высвобождает энергию . Это вызывает несколько вопросов:
Возможно ли преобразование этой тепловой энергии в электрическую?
Можем ли мы использовать химическую реакцию с обменом электронами для производства электричества?
Если бы мы подали электрический ток, могли бы мы, , вызвать какую-нибудь химическую реакцию?
Ответам на эти вопросы и посвящена данная глава:
Энергия химической реакции может быть преобразована в электрическую потенциальную энергию, которая образует электрический ток.

При переносе электронов в химической реакции может протекать электрический ток.
Если вы подаете электрический ток, он может вызвать химическую реакцию, подавая электроны (и потенциальную энергию), необходимые для реакций, протекающих внутри элемента.
Эти типы реакций называются электрохимическими реакциями . Электрохимическая реакция — это реакция, в которой:
химическая реакция создает разность электрических потенциалов и, следовательно, электрический ток во внешних проводящих проводах
или
электрический ток обеспечивает электрическую потенциальную энергию и электроны, поэтому происходит химическая реакция
- Электрохимическая реакция
Электрохимическая реакция включает перенос электронов.
 Происходит преобразование химической потенциальной энергии в электрическую потенциальную энергию, электрическую потенциальную энергию или в химическую потенциальную энергию.
Происходит преобразование химической потенциальной энергии в электрическую потенциальную энергию, электрическую потенциальную энергию или в химическую потенциальную энергию.
Электрохимия — это раздел химии, изучающий эти электрохимические реакции. Электрохимическая ячейка — это устройство, в котором происходят электрохимические реакции.
- Ячейка электрохимическая
Устройство, в котором происходят электрохимические реакции.
Зарегистрируйтесь, чтобы получить стипендию и возможности карьерного роста. Используйте практику Сиявулы, чтобы получить наилучшие возможные оценки.
Зарегистрируйтесь, чтобы разблокировать свое будущееЭлектрохимические реакции
Упражнение 13.3\ (\ text {CuO} (\ text {s}) + \ text {H} _ {2} (\ text {g}) \) \ (\ to \) \ (\ text {Cu} (\ text {s}) + \ text {H} _ {2} \ text {O} (\ text {g}) \)
Степень окисления \ (\ text {O} \) равна \ (- \ text {2} \). {2 -} \) равна \ (- \ text {8} \).{2 +} \) получает два электрона и превращается в \ (\ text {Fe} \). Железо уменьшено на .
{2 -} \) равна \ (- \ text {8} \).{2 +} \) получает два электрона и превращается в \ (\ text {Fe} \). Железо уменьшено на .
\ (\ text {Zn} (\ text {s}) + 2 \ text {AgNO} _ {3} (\ text {aq}) \) \ (\ to \) \ (2 \ text {Ag} ( \ text {s}) + \ text {Zn} (\ text {NO} _ {3}) _ {2} (\ text {aq}) \)
Степень окисления иона \ (\ text {NO} _ {3} \) равна \ (- \ text {1} \) как реагент и как продукт.
Степень окисления \ (\ text {O} \) равна \ (- \ text {2} \). \ (\ text {O} \) не окисляется и не восстанавливается.{2 -} \)
Существует два типа электрохимических ячеек, которые мы рассмотрим более подробно в этой главе: гальванические ячейки и электролитические ячейки . Прежде чем мы подробно рассмотрим гальванические и электролитические ячейки, вам необходимо знать несколько определений:
- Электрод
Электрод — это электрический проводник, который соединяет электрохимические частицы из раствора с внешней электрической цепью ячейки.

В электрохимической ячейке есть два типа электродов: \ (\ color {blue} {\ textbf {anode}} \) и \ (\ color {red} {\ textbf {cathode}} \).
\ (\ color {blue} {\ text {Oxidation}} \) всегда встречается в \ (\ color {blue} {\ textbf {anode}} \), а \ (\ color {red} {\ text {сокращение }} \) всегда встречается в \ (\ color {red} {\ textbf {cathode}} \). Поэтому, пытаясь определить, на какой электрод вы смотрите в первую очередь, определите, происходит ли там окисление или восстановление.Легкий способ запомнить это:
Окисление — потеря электронов .
Редукция — это усиление электронов .
\ (\ color {blue} {\ textbf {O}} \) xidation \ (\ color {blue} {\ textbf {i}} \) s \ (\ color {blue} {\ textbf {l }} \) осс электронов | \ (\ color {blue} {\ textbf {OIL}} \) |
\ (\ color {red} {\ textbf {R}} \) образование \ (\ color {red} {\ textbf {i}} \) s \ (\ color {red} {\ textbf {g}} \) в электронах | \ (\ color {red} {\ textbf {RIG}} \) |
\ (\ color {blue} {\ textbf {O}} \) xidation — это \ (\ color {blue} {\ textbf {l}} \) скопление электронов на узел \ (\ color {blue} {\ textbf {a}} \) | \ (\ color {blue} {\ textbf {An Ox}} \) |
\ (\ color { red} {\ textbf {Red}} \) действие — это прирост электронов на участке \ (\ color {red} {\ textbf {cat}} \) | \ (\ color {red} {\ textbf { Красный кот}} \) |
Таблица 13. 1: Краткое изложение фраз, которые помогут вам запомнить правила окисления и восстановления.
1: Краткое изложение фраз, которые помогут вам запомнить правила окисления и восстановления.
Электрод помещается в раствор электролита внутри ячейки. Если ячейка состоит из двух отсеков, эти отсеки будут соединены солевым мостиком .
- Электролит
Электролит — это раствор, который содержит свободные ионы и поэтому ведет себя как проводник заряда (электрический проводник) в растворе.
- Соляной мост
Солевой мостик — это материал, который содержит раствор электролита и действует как соединение между двумя полуэлементами (замыкает цепь). Он поддерживает электрическую нейтральность внутри и между электролитами в отсеках полуэлементов.
Гальванические элементы (ESCR5)
Гальванический элемент (который также иногда называют вольтовым элементом или влажным элементом ) состоит из двух полуэлементов, которые преобразуют химическую потенциальную энергию в электрическую потенциальную энергию.
- Гальванический элемент
Гальванический элемент — это электрохимический элемент, который преобразует химическую потенциальную энергию в электрическую потенциальную энергию посредством спонтанной химической реакции.
В гальваническом элементе два полуэлемента. Каждая полуячейка содержит электрод в электролите. Разделение необходимо для предотвращения прямого химического контакта реакций окисления и восстановления, создающего разность потенциалов. Электроны, высвобождаемые в реакции окисления, проходят через внешнюю цепь (и выполняют работу), прежде чем будут использованы в реакции восстановления.{+} (\ text {aq}) \) раствор электролита.
Электроны, высвобождаемые в \ (\ color {blue} {\ textbf {окисление}} \) металла, остаются на \ (\ color {blue} {\ textbf {анод}} \), в то время как катионы металла образуются перейти в раствор.
Металл на катоде — Y. {+} (\ text {aq}) + \ text {Y} (\ text {s}) \) .{+} {\ textbf {(aq)}}} \) \ (| \) \ (\ color {red} {\ textbf {Y (s)}} \)
{+} (\ text {aq}) + \ text {Y} (\ text {s}) \) .{+} {\ textbf {(aq)}}} \) \ (| \) \ (\ color {red} {\ textbf {Y (s)}} \)
Условно:
\ (\ color {blue} {\ textbf {anode}} \) всегда пишется на \ (\ color {blue} {\ textbf {left}} \).
\ (\ color {red} {\ textbf {cathode}} \) всегда пишется на \ (\ color {red} {\ textbf {right}} \).
Анодная и катодная полуэлементы разделены знаком \ (|| \), представляющим солевой мостик.
Различные фазы в каждой полуячейке (твердая (ые) и водная (водн.) Здесь) разделены знаком \ (| \).
Электроды в каждой полуячейке соединены проводом во внешней цепи. Между отдельными полуячейками существует также солевой мостик.
Гальванический элемент использует реакции, которые происходят на двух электродах, для производства электроэнергии, т. е.е. реакция происходит без необходимости добавления энергии.
е.е. реакция происходит без необходимости добавления энергии.
Спонтанная реакция — это реакция, которая происходит без потребности во внешней энергии. Обратитесь к подразделу о спонтанности для получения дополнительной информации.
Реакцию цинка и меди, которую вы провели в 11 классе, можно изменить, чтобы получить гальванический элемент. Слитки цинка и меди используются в качестве электродов , с растворами сульфата цинка (II) и сульфата меди (II) в качестве электролитов .
В эксперименте с гальваническим элементом убедитесь, что паста хлорида натрия имеет высокую концентрацию и заполняет U-образную трубку для достижения наилучших результатов.{-3} $} \)), \ (\ text {NaCl} \) вставить
Измерительные весы, две \ (\ text {250} \) \ (\ text {ml} \) мензурки, U-образная трубка, вата, амперметр с нулевым центром, соединительный провод.
Чистящий этанол, эфир (при наличии)
Метод
Взвесьте медные и цинковые пластины и запишите их массу.

Налейте \ (\ text {200} \) \ (\ text {ml} \) раствор сульфата цинка в стакан и поместите цинковую пластинку в стакан.
Налейте \ (\ text {200} \) \ (\ text {ml} \) раствор сульфата меди (II) во второй стакан и поместите медную пластину в стакан.
Заполните U-образную трубку пастой \ (\ text {NaCl} \) и заклейте концы трубок ватой (образуя солевой мостик). Ватка поможет предотвратить растворение пасты в электролите.
Подключите цинковую и медную пластины к амперметру с нулевым центром и наблюдайте за амперметром.
Поместите U-образную трубку так, чтобы один конец находился в растворе сульфата меди (II), а другой конец — в растворе сульфата цинка. Наблюдайте за амперметром.
Снимите амперметр и соедините медную и цинковую пластины друг с другом напрямую с помощью медной проволоки.
 Оставить постоять примерно на сутки.
Оставить постоять примерно на сутки.Через день снимите две пластины и промойте их: сначала дистиллированной водой, затем спиртом и, наконец, эфиром (если есть).Просушите тарелки феном.
Взвесьте цинковые и медные пластины и запишите их массу.
Примечание
Вольтметр также можно использовать вместо амперметра с нулевым центром. Вольтметр с нулевым центром будет измерять разность потенциалов на ячейке (а не поток электронов), а амперметр будет измерять ток.
Обсуждение
Амперметр записал показания до того, как солевой мостик был помещен в растворы?
Амперметр записал показания после того, как солевой мостик был помещен в растворы? Если да, то в каком направлении течет ток?
Заполните таблицу ниже:
Пластина
Начальная масса
Конечная масса
Цинк
6
Как изменилась масса цинковых и медных пластин?
На основании того, что вы знаете об окислении и восстановлении, почему произошли эти массовые изменения?
Какой электрод является анодом, а какой катодом?
Результаты
В ходе эксперимента вы должны были заметить следующее:
При отсутствии соляного мостика на амперметре не было показаний.

Когда был подключен солевой мостик, показания были записаны на амперметре.
Направление потока электронов — от цинковой пластины к медной пластине, что означает, что обычный ток течет от медной пластины к цинковой пластине.
После того, как пластины были соединены напрямую друг с другом и оставлены на сутки, их масса изменилась.Масса цинковой пластины уменьшилась, а масса медной пластины увеличилась.
\ (\ color {blue} {\ textbf {O}} \) xidation \ (\ color {blue} {\ textbf {i}} \) s \ (\ color {blue} {\ textbf {l}} \ ) осс электронов, \ (\ color {red} {\ textbf {R}} \) выделение \ (\ color {red} {\ textbf {i}} \) s \ (\ color {red} {\ textbf { G}} \) ина электронов.
Цинковый электрод потерял массу. Это означает, что твердые атомы металлического Zn становятся ионами и переходят в раствор электролита: \ (\ text {Zn} (\ text {s}) \) \ (\ to \) \ (\ text {Zn} ^ {2+} (\ text {aq}) + 2 \ text {e} ^ {-} \).
 {-} \) \ (\ to \) \ (\ text {Cu} (\ text {s}) \). Восстановление происходит на медном электроде.
{-} \) \ (\ to \) \ (\ text {Cu} (\ text {s}) \). Восстановление происходит на медном электроде.\ (\ color {blue} {\ textbf {Ox}} \) idation — потеря электронов при оде \ (\ color {blue} {\ textbf {an}} \). Окисление происходит на цинковом электроде, поэтому цинковая пластина является анодом.
\ (\ color {red} {\ textbf {Red}} \) действие — это прирост электронов на пути \ (\ color {red} {\ textbf {cat}} \). Восстановление происходит на медном электроде, поэтому медная пластина является катодом.Ионы {2 +} \) произошли здесь, чтобы произвести больше металлической меди.
В этом эксперименте важно отметить следующее:
химические реакции, которые происходят на двух электродах, вызывают электрический ток, протекающий через внешнюю цепь
общая реакция должна быть спонтанной окислительно-восстановительной реакцией
химическая энергия преобразуется в электрическую энергию
цинк-медный элемент является одним из примеров гальванического элемента
Итальянский врач и анатом Луиджи Гальвани ознаменовал рождение электрохимии, установив связь между химическими реакциями и электричеством.
 В 1780 году Гальвани обнаружил, что когда два разных металла (например, медь и цинк) были соединены друг с другом, а затем оба одновременно касались разных частей нерва лягушачьей ноги, они заставляли ногу сокращаться. Он назвал это «животным электричеством».
В 1780 году Гальвани обнаружил, что когда два разных металла (например, медь и цинк) были соединены друг с другом, а затем оба одновременно касались разных частей нерва лягушачьей ноги, они заставляли ногу сокращаться. Он назвал это «животным электричеством».В цинко-медной ячейке медная и цинковая пластины являются электродами . Соляной мостик играет очень важную роль в гальваническом элементе:
Раствор электролита состоит из катионов металлов и анионов-спектаторов.{+} \) ионы перемещаются из солевого мостика в отсек катодной полуячейки.
Солевой мостик действует как среда переноса, которая позволяет ионам проходить через них, не позволяя различным растворам смешиваться и напрямую реагировать. Это позволяет уравновесить заряды в растворах электролита и позволяет реакциям в ячейке продолжаться.
Без солевого мостика поток электронов во внешнем контуре полностью прекращается. Это потому, что соляной мостик необходим для замыкания цепи.

Электролитические ячейки (ESCR6)
В электролизере электрическая потенциальная энергия преобразуется в химическую потенциальную энергию. Электролитическая ячейка использует электрический ток, чтобы вызвать конкретную химическую реакцию, которая в противном случае не имела бы места.
- Электролизер
Электролитическая ячейка — это электрохимическая ячейка, которая преобразует электрическую потенциальную энергию в химическую потенциальную энергию, используя электричество для запуска несамопроизвольной химической реакции.
Иногда гальванические элементы называют просто электрохимическими ячейками. Хотя они являются электрохимическими ячейками, электролитические ячейки также являются электрохимическими ячейками. Однако электролитические и гальванические элементы — это не одно и то же.
Электролитическая ячейка активируется за счет приложения электрического потенциала к электродам, чтобы вызвать внутреннюю химическую реакцию между электродами и ионами, находящимися в растворе электролита.
 Этот процесс называется электролиз .
Этот процесс называется электролиз .- Электролиз
Электролиз — это метод запуска химических реакций путем пропускания электрического тока через электролит.
Рисунок 13.6: Эскиз электролитической ячейки.
В электролитической ячейке (например, ячейке, показанной на рисунке 13.6):
Раствор электролита состоит из катионов металлов и спектральных анионов.
Реакции окисления и восстановления происходят в одном контейнере, но не самопроизвольно.Для работы они требуют подключения электродов к внешнему источнику питания.
Электроды в электролитической ячейке могут быть из одного или разных металлов. Принцип тот же. Пусть будет только один металл, пусть это будет металл Z.
Электрод подключен к \ (\ color {blue} {\ textbf {положительной клемме}} \) батареи.

Чтобы сбалансировать заряд на \ (\ color {blue} {\ textbf {положительном электроде}} \), атомы металла \ (\ color {blue} {\ textbf {окисленные}} \) образуют ионы металлов.{-}} \)
\ (\ color {blue} {\ textbf {Ox}} \) idation — это потеря в оде \ (\ color {blue} {\ textbf {an}} \), поэтому этот электрод является \ (\ color { синий} {\ textbf {анод}} \).
Электрод подключен к \ (\ color {red} {\ textbf {отрицательной клемме}} \) батареи.
Когда положительные ионы контактируют с \ (\ color {red} {\ textbf {отрицательным электродом}} \), ионы приобретают электроны и становятся \ (\ color {red} {\ textbf {Reddated}} \).{+} (\ text {aq}) + \ text {Z} (\ text {s}) \). Хотя это может показаться тривиальным, это важный метод очистки металлов (см. Раздел 13.7).
В эксперименте с движением окрашенных ионов для создания буферного золя аммиака и хлорида аммония
Эволюция морфологии цинкового электрода в никель-цинковых батареях с высокой плотностью энергии
Призматические никель-цинковые (NiZn) батареи с плотностью энергии более 100 Вт · ч кг -1 были приготовлены с использованием цинковых электродов различной исходной морфологии.
 Исследовано влияние исходной морфологии цинкового электрода на емкость аккумулятора. Сканирующая электронная микроскопия (SEM) и дифракция рентгеновских лучей (XRD) показывают, что первоначальная морфология цинкового электрода резко меняется после нескольких циклов зарядки / разрядки независимо от исходного использованного порошка ZnO. Электроды ZnO, полученные с использованием порошков ZnO, синтезированных из ZnCl 2 и Zn (NO 3 ) 2 , приводят к средней плотности энергии батареи в диапазоне от 92 Втч кг -1 до 109 Втч кг -1 при использовании обычного ZnO порошок приводит к более высокой плотности энергии, 118 Втч кг -1 .Средняя разрядная емкость цинковых электродов варьируется от 270 до 345 мА г -1 , что намного ниже, чем значения, указанные в литературе для порошков нано ZnO. Более высокая площадь поверхности электрода или более высокая разрядная емкость электрода не обязательно означает более высокую плотность энергии батареи.
Исследовано влияние исходной морфологии цинкового электрода на емкость аккумулятора. Сканирующая электронная микроскопия (SEM) и дифракция рентгеновских лучей (XRD) показывают, что первоначальная морфология цинкового электрода резко меняется после нескольких циклов зарядки / разрядки независимо от исходного использованного порошка ZnO. Электроды ZnO, полученные с использованием порошков ZnO, синтезированных из ZnCl 2 и Zn (NO 3 ) 2 , приводят к средней плотности энергии батареи в диапазоне от 92 Втч кг -1 до 109 Втч кг -1 при использовании обычного ZnO порошок приводит к более высокой плотности энергии, 118 Втч кг -1 .Средняя разрядная емкость цинковых электродов варьируется от 270 до 345 мА г -1 , что намного ниже, чем значения, указанные в литературе для порошков нано ZnO. Более высокая площадь поверхности электрода или более высокая разрядная емкость электрода не обязательно означает более высокую плотность энергии батареи.
1. Введение
Никель-цинковые (NiZn) батареи являются одними из старейших, но все еще многообещающих электрохимических накопителей энергии для гибридных / электрических транспортных средств и портативных электрических / электронных устройств.Имеющиеся в продаже NiZn-аккумуляторы обладают умеренной удельной энергией (55–85 Втч, кг –1 ), высокой удельной мощностью (140–200 Втч, кг –1 ), высоким потенциалом разомкнутого круга (1,705 В) и номинальным напряжением элемента 1,6 В, что больше, чем у NiCd и NiMH аккумуляторов [1, 2]. Кроме того, по сравнению с легкодоступными аккумуляторными технологиями, такими как литий-ионные, никель-кадмиевые и никель-металлогидридные аккумуляторы, NiZn-аккумуляторы представляют собой недорогую и экологически безопасную альтернативу с сопоставимой, если не лучшей производительностью на единицу веса.Однако технология NiZn еще не реализовала свой полный потенциал из-за множества проблем, которые хорошо документированы в литературе [3–5].
 Среди этих проблем — изменение формы цинкового электрода с увеличением количества циклов заряда / разряда, пассивация цинкового электрода и дендритный рост цинка, ведущий к короткому замыканию батареи. В процессе разряда цинк растворяется в виде иона цинката () в щелочном электролите до того, как оксид цинка осаждается. Высокоподвижные ионы цинката концентрируются около дна электрода и выпадают в осадок в виде оксида цинка, когда достигается предел растворимости.Этот процесс приводит к неоднородности толщины осажденного цинка на электроде с увеличением количества циклов зарядки / разрядки и, в сочетании с дендритным ростом цинка во время зарядки, в конечном итоге вызывает короткое замыкание аккумулятора. Пассивация также считается одной из серьезных причин износа цинковых батарей. Это явление происходит, когда растворение цинка создает ситуацию, в которой достигается предел растворимости цинката в электролите вблизи поверхности цинкового электрода, и на поверхности электрода образуется изолирующий слой оксида цинка.
Среди этих проблем — изменение формы цинкового электрода с увеличением количества циклов заряда / разряда, пассивация цинкового электрода и дендритный рост цинка, ведущий к короткому замыканию батареи. В процессе разряда цинк растворяется в виде иона цинката () в щелочном электролите до того, как оксид цинка осаждается. Высокоподвижные ионы цинката концентрируются около дна электрода и выпадают в осадок в виде оксида цинка, когда достигается предел растворимости.Этот процесс приводит к неоднородности толщины осажденного цинка на электроде с увеличением количества циклов зарядки / разрядки и, в сочетании с дендритным ростом цинка во время зарядки, в конечном итоге вызывает короткое замыкание аккумулятора. Пассивация также считается одной из серьезных причин износа цинковых батарей. Это явление происходит, когда растворение цинка создает ситуацию, в которой достигается предел растворимости цинката в электролите вблизи поверхности цинкового электрода, и на поверхности электрода образуется изолирующий слой оксида цинка. В результате этого короткий срок службы и / или плохие электрохимические характеристики ограничивают масштабное внедрение NiZn батарей [3, 6–8]. Некоторые из этих проблем прямо или косвенно связаны с образованием растворимых ионов цинката в щелочном растворе во время работы от батареи. Предел растворимости цинката определяется температурой и pH щелочного раствора. Было предпринято множество попыток минимизировать растворимость и перемещение продуктов окисления цинка в щелочных растворах и улучшить физическую и химическую стабильность цинкового электрода при увеличении числа циклов заряда / разряда.Эти попытки включают, но не ограничиваются ими, использование органических и неорганических добавок в цинковых электродах и электролите, настройку структуры сепаратора для минимизации роста дендритного цинка [9, 10] и использование электродов различной геометрии [11, 12]. Одним из эффективных способов минимизировать указанные выше проблемы является использование различных оксидных добавок, таких как Ca (OH) 2 [13, 14], Bi 2 O 3 [15], PbO [16], TiO 2 [17] и In 2 O 3 [18] в цинковом электроде.
В результате этого короткий срок службы и / или плохие электрохимические характеристики ограничивают масштабное внедрение NiZn батарей [3, 6–8]. Некоторые из этих проблем прямо или косвенно связаны с образованием растворимых ионов цинката в щелочном растворе во время работы от батареи. Предел растворимости цинката определяется температурой и pH щелочного раствора. Было предпринято множество попыток минимизировать растворимость и перемещение продуктов окисления цинка в щелочных растворах и улучшить физическую и химическую стабильность цинкового электрода при увеличении числа циклов заряда / разряда.Эти попытки включают, но не ограничиваются ими, использование органических и неорганических добавок в цинковых электродах и электролите, настройку структуры сепаратора для минимизации роста дендритного цинка [9, 10] и использование электродов различной геометрии [11, 12]. Одним из эффективных способов минимизировать указанные выше проблемы является использование различных оксидных добавок, таких как Ca (OH) 2 [13, 14], Bi 2 O 3 [15], PbO [16], TiO 2 [17] и In 2 O 3 [18] в цинковом электроде. Эти добавки могут снизить концентрацию продуктов окисления цинка и улучшить электронную проводимость и распределение тока [14]. Связующие вещества или гели, такие как силикат натрия [19], тапиока [20], политетрафторэтилен [21, 22], гель Carbopol [23, 24] и саго, который представляет собой крахмал, экстрагированный из стеблей пальмы [25], использовались для увеличения использование активного материала и эффективная площадь поверхности цинкового электрода. Сообщалось, что добавление силиката натрия в качестве связующего увеличивает производительность батареи [19].Также сообщалось, что использование крахмала тапиоки в качестве связующего для пористого цинкового электрода увеличивает удельную емкость [20]. В щелочных растворах в качестве ингибиторов коррозии цинка используются различные органические добавки. Некоторые из них либо дороги, либо токсичны и не безвредны для окружающей среды, что ограничивает их использование в батареях. Одним из немногих нетоксичных и дешевых органических материалов является полиэтиленгликоль (ПЭГ) [26, 27].
Эти добавки могут снизить концентрацию продуктов окисления цинка и улучшить электронную проводимость и распределение тока [14]. Связующие вещества или гели, такие как силикат натрия [19], тапиока [20], политетрафторэтилен [21, 22], гель Carbopol [23, 24] и саго, который представляет собой крахмал, экстрагированный из стеблей пальмы [25], использовались для увеличения использование активного материала и эффективная площадь поверхности цинкового электрода. Сообщалось, что добавление силиката натрия в качестве связующего увеличивает производительность батареи [19].Также сообщалось, что использование крахмала тапиоки в качестве связующего для пористого цинкового электрода увеличивает удельную емкость [20]. В щелочных растворах в качестве ингибиторов коррозии цинка используются различные органические добавки. Некоторые из них либо дороги, либо токсичны и не безвредны для окружающей среды, что ограничивает их использование в батареях. Одним из немногих нетоксичных и дешевых органических материалов является полиэтиленгликоль (ПЭГ) [26, 27]. Было обнаружено, что ингибирующая коррозия способность ПЭГ превосходит кислотную форму полиоксиэтиленалкилфосфатного эфира при использовании в цинковом электроде [27, 28].Хотя частично успешные, ни одна из описанных в литературе попыток не предоставила окончательного решения проблемы короткого срока службы и плохой работы цинкового электрода из-за изменения формы и короткого замыкания в результате роста дендритного цинка во время зарядки.
Было обнаружено, что ингибирующая коррозия способность ПЭГ превосходит кислотную форму полиоксиэтиленалкилфосфатного эфира при использовании в цинковом электроде [27, 28].Хотя частично успешные, ни одна из описанных в литературе попыток не предоставила окончательного решения проблемы короткого срока службы и плохой работы цинкового электрода из-за изменения формы и короткого замыкания в результате роста дендритного цинка во время зарядки.В дополнение к использованию добавок изначально предполагалось, что, тщательно контролируя морфологию электрода, можно будет минимизировать изменение формы цинкового электрода. Частицы ZnO различной морфологии (нанопроволоки, гексагональные наностержни и др.)) могут быть получены разными методами [29–31]. В литературе есть несколько исследований о влиянии исходной морфологии цинкового электрода на электрохимические характеристики батареи [6–8, 32, 33]. Некоторые из этих исследований были сосредоточены на контроле морфологии цинкового электрода с помощью нанопроволок, наностержней и волокон ZnO.
 Например, Yang et al. исследовали нанопроволоки ZnO, синтезированные гидротермальным методом, в качестве электродного материала [32]. Сообщалось, что структуры нанопроволоки ломались и превращались в наностержни во время циклов зарядки / разрядки и подавляли рост дендритного цинка.Использование призматического ZnO, синтезированного путем гомогенного осаждения, в качестве электродного материала исследовали Yuan et al. [8]. Результаты показали, что напряжение разряда в средней точке, стабильность цикла и устойчивость к пассивации были улучшены по сравнению с коммерческим ZnO с типичными гексагональными призматическими частицами. Юань и его коллеги подробно изучили влияние морфологии и размера ZnO на характеристики цинкового электрода [6]. По сравнению с другими морфологиями частицы ZnO с наностержнями демонстрируют лучшую стабильность электрохимического цикла и характеристики заряда / разряда.Их результаты показали, что обычные гексагональные частицы ZnO превращаются в чешуйчатые кристаллы, что снижает производительность.
Например, Yang et al. исследовали нанопроволоки ZnO, синтезированные гидротермальным методом, в качестве электродного материала [32]. Сообщалось, что структуры нанопроволоки ломались и превращались в наностержни во время циклов зарядки / разрядки и подавляли рост дендритного цинка.Использование призматического ZnO, синтезированного путем гомогенного осаждения, в качестве электродного материала исследовали Yuan et al. [8]. Результаты показали, что напряжение разряда в средней точке, стабильность цикла и устойчивость к пассивации были улучшены по сравнению с коммерческим ZnO с типичными гексагональными призматическими частицами. Юань и его коллеги подробно изучили влияние морфологии и размера ZnO на характеристики цинкового электрода [6]. По сравнению с другими морфологиями частицы ZnO с наностержнями демонстрируют лучшую стабильность электрохимического цикла и характеристики заряда / разряда.Их результаты показали, что обычные гексагональные частицы ZnO превращаются в чешуйчатые кристаллы, что снижает производительность. Вен и его коллеги сообщили, что электрохимические характеристики полого сплава ZnO и гексагонального конусообразного ZnO, полученного гидротермальным методом, были лучше по сравнению с обычным ZnO в качестве анодных материалов для ячеек NiZn, а полые частицы ZnO, полученные методом плавления, показали лучшую стабильность электрохимического цикла и заряд. разрядная производительность [33].
Вен и его коллеги сообщили, что электрохимические характеристики полого сплава ZnO и гексагонального конусообразного ZnO, полученного гидротермальным методом, были лучше по сравнению с обычным ZnO в качестве анодных материалов для ячеек NiZn, а полые частицы ZnO, полученные методом плавления, показали лучшую стабильность электрохимического цикла и заряд. разрядная производительность [33].Здесь мы представляем призматические NiZn аккумуляторы с различной исходной морфологией цинкового электрода, имеющие удельную энергию в литий-ионной области более 100 Вт · ч кг −1 .Порошки ZnO для цинковых электродов были синтезированы из различных прекурсоров, ZnCl 2 и Zn (NO 3 ) 2 · 6H 2 О. В сочетании с обычным порошком ZnO, обычно используемым в коммерческих NiZn батареях, эффект исходного цинкового электрода морфология от емкости батареи была исследована.
2. Экспериментальная
2.1. Приготовление порошков ZnO
В данном исследовании использовались три различных порошка ZnO.
 В дополнение к коммерческому порошку ZnO, полученному механохимическими методами при повышенных температурах (Киметсан, 99%), были синтезированы два других порошка ZnO с различной морфологией, как описано ниже.
В дополнение к коммерческому порошку ZnO, полученному механохимическими методами при повышенных температурах (Киметсан, 99%), были синтезированы два других порошка ZnO с различной морфологией, как описано ниже.2.1.1. Синтез порошка ZnO из ZnCl 2
Наноразмерные сферические частицы ZnO получали простым методом осаждения, как описано в литературе [34]. Все 100 мл раствора, содержащего 0,2 M КОН (Merck) и 0,02 M триэтаноламин (TEA) (Kimetsan, 99%) в качестве поверхностно-активного вещества, медленно добавляли к 100 мл 0,1 M раствора ZnCl 2 (Merck) при сильном механическом перемешивании. Ультразвуковая обработка (WUC-D06H, Wisd) проводилась в течение 45 минут при 50 ° C. Осадок отделяли от жидкой фазы центрифугированием (Sigma, 3–16 ПК) при 4000 об / мин в течение 5 мин.Затем твердую фазу трижды промывали 500 мл 0,1 М раствора NH 4 OH (Sigma Aldrich, 28-29%). Наконец, твердую фазу сушили при 50 ° C в течение 15 часов, а затем запекали при 200 ° C в течение 2 часов в печи.

2.1.2. Синтез порошка ZnO из Zn (NO 3 ) 2
Наноразмерные пластинчатые частицы ZnO получали простым методом осаждения, который обычно используется в литературе [35]. Всего 27,85 мл 8 M NaOH (Merck, 98%) медленно добавляли к 100 мл 1 M раствора Zn (NO 3 ) 2 · 6H 2 O (Scharlau, 98%) при механическом перемешивании. при 20 ° С.Затем к смеси добавляли сверхчистую воду (22,15 мл), чтобы получить значение pH около 13, и раствор выдерживали при 20 ° C в течение 30 минут. Осадок отделяли от жидкой фазы центрифугированием при 4000 об / мин в течение 5 мин. Твердую фазу трижды промывали сверхчистой водой. Наконец, твердую фазу сушили при 50 ° C в течение 20 часов, а затем запекали при 200 ° C в течение 2 часов в печи.
2.2. Подготовка призматических батарей
Призматические никель-цинковые батареи с цинковыми электродами, имеющими различную исходную морфологию порошка ZnO, были подготовлены для оценки изменения морфологии цинкового электрода во время работы батареи и его влияния на емкость батареи.
 Пасту цинкового электрода готовили путем механического смешивания 3 г порошка оксида цинка, 0,03 г гидроксида кальция и 0,08 г оксида свинца (II) с предварительно приготовленными 1 мл 10% -ного раствора PEG и 1,6 мл 6 M растворов KOH, содержащих 0,35 г растворенной целлюлозы. Затем пасту наносили на одну сторону оловянного никелевого токосъемника толщиной мкм толщиной м с использованием трафарета для формирования однородного слоя. Наклеенные Ni (OH) 2 электродов с удвоенной емкостью электродов из цинка использовали, чтобы убедиться, что емкость батареи не ограничивается никелевым электродом.Ni электродную пасту наносили на обе стороны токосъемника из никелевой фольги с помощью трафарета. Коммерческие сепараторы на основе целлюлозы (Ocalı A. S.) обильно смачивали 6 М КОН перед тем, как их поместили между электродами из никеля и цинка. Полученная структура электрода Zn / Ni / Zn была плотно закрыта между двумя пластинами слюды под давлением. Батареи NiZn с цинковыми электродами, имеющими сферические частицы ZnO, синтезированные из ZnCl 2 (образец преобладает A1), пластина , -подобные частицы ZnO, синтезированные Zn (NO 3 ) 2 (образец B1), и коммерческий порошок ZnO (образец C1) были приготовлены по тому же рецепту.
Пасту цинкового электрода готовили путем механического смешивания 3 г порошка оксида цинка, 0,03 г гидроксида кальция и 0,08 г оксида свинца (II) с предварительно приготовленными 1 мл 10% -ного раствора PEG и 1,6 мл 6 M растворов KOH, содержащих 0,35 г растворенной целлюлозы. Затем пасту наносили на одну сторону оловянного никелевого токосъемника толщиной мкм толщиной м с использованием трафарета для формирования однородного слоя. Наклеенные Ni (OH) 2 электродов с удвоенной емкостью электродов из цинка использовали, чтобы убедиться, что емкость батареи не ограничивается никелевым электродом.Ni электродную пасту наносили на обе стороны токосъемника из никелевой фольги с помощью трафарета. Коммерческие сепараторы на основе целлюлозы (Ocalı A. S.) обильно смачивали 6 М КОН перед тем, как их поместили между электродами из никеля и цинка. Полученная структура электрода Zn / Ni / Zn была плотно закрыта между двумя пластинами слюды под давлением. Батареи NiZn с цинковыми электродами, имеющими сферические частицы ZnO, синтезированные из ZnCl 2 (образец преобладает A1), пластина , -подобные частицы ZnO, синтезированные Zn (NO 3 ) 2 (образец B1), и коммерческий порошок ZnO (образец C1) были приготовлены по тому же рецепту. Схема призматических батарей, в которых никелевый электрод помещен между двумя цинковыми электродами, показана на рисунке 1.
Схема призматических батарей, в которых никелевый электрод помещен между двумя цинковыми электродами, показана на рисунке 1.
2.3. Характеристика электродов
Кристаллическая структура промышленных порошков ZnO и порошков ZnO, полученных методами осаждения и циклических цинковых электродов, была охарактеризована методом порошковой дифракции рентгеновских лучей (дифрактометр Phillips ™ Xpert с излучением Cu K α ) при скорости сканирования 0,139 θ с −1 .Электронная микроскопия (FEI Quanta 250, оснащенная системой Oxford EDX) использовалась для оценки морфологии порошков ZnO и цинковых электродов до и после циклов заряда / разряда. Площадь поверхности порошков ZnO определялась анализом Брунауэра-Эмметта-Теллера (БЭТ) (Quantachrome Autosorb) с процессом адсорбции / десорбции азота.
2.4. Тесты заряда / разряда
Тесты заряда / разряда проводились с использованием источника постоянного тока (TT Technic RXN 305D), который работает в режиме ограничения тока или напряжения, и компьютеризированного анализатора батареи (CBA IV 4 Pro).
 Все испытания проводились при комнатной температуре. Зарядка призматических NiZn аккумуляторов выполнялась при фиксированном напряжении (1,94 В) до тех пор, пока зарядный ток не упал до 0,01 А. Испытания на разряд проводились при фиксированном токе 0,8 А до тех пор, пока напряжение аккумулятора не упало до 1,0 В.
Все испытания проводились при комнатной температуре. Зарядка призматических NiZn аккумуляторов выполнялась при фиксированном напряжении (1,94 В) до тех пор, пока зарядный ток не упал до 0,01 А. Испытания на разряд проводились при фиксированном токе 0,8 А до тех пор, пока напряжение аккумулятора не упало до 1,0 В.3. Результаты и обсуждение
Рентгенограммы промышленного порошка ZnO и порошков ZnO, синтезированных из ZnCl 2 и Zn (NO 3 ) 2 · 6H 2 O, представлены на рисунке 2. Пики XRD порошка ZnO (структура вюрцита) при 2 θ значения 31.77 °, 34,42 °, 36,25 °, 47,54 °, 56,59 °, 62,85 °, 66,37 °, 67,94 ° и 69,08 ° соответствуют (100), (002), (101), (102), (110), ( 103), (200), (112) и (201) соответственно (номер файла данных JCPDS-2: 79-2205). Детальный рентгеноструктурный анализ показывает, что синтезированные порошки содержат только ZnO, и никаких следов Zn (OH) 2 не наблюдается. Также очевидно, что коммерческий порошок ZnO имеет большую кристалличность по сравнению с синтезированными порошками ZnO.

На рис. 3 показаны СЭМ-изображения порошков ZnO, синтезированных из ZnCl 2 и Zn (NO 3 ) 2 · 6H 2 O, а также коммерческого порошка ZnO.СЭМ-изображения порошков ZnO, синтезированных из ZnCl 2 , показывают сферические частицы диаметром от 20 до 40 нм. По сравнению с ZnO, синтезированным из ZnCl 2 , порошок ZnO, синтезированный из Zn (NO 3 ) 2 · 6H 2 O, имеет другую морфологию с пластинчатыми структурами и нанолистами, смешанными с игольчатыми частицами размером до микрометра. в длину, как показано на рисунке 3 (б). Хорошо известно, что нанолисты и нанотрубки могут быть получены путем регулирования гидротермальной продолжительности с использованием прекурсора Zn (NO 3 ) 2 · 6H 2 O [36–38].Морфология коммерческого ZnO, синтезированного механохимическим методом, резко отличается от морфологии синтезированных порошков ZnO.
 На рисунке 3 (c) наблюдается широкий диапазон распределения частиц по размерам со смесью пластин, стержней и призматических частиц длиной до нескольких микрометров.
На рисунке 3 (c) наблюдается широкий диапазон распределения частиц по размерам со смесью пластин, стержней и призматических частиц длиной до нескольких микрометров.Площадь поверхности электрода, доступная для электрохимических реакций, играет ключевую роль в производительности батареи. В батарее NiZn более высокая площадь поверхности цинкового электрода должна приводить к улучшенному использованию материалов и более высокой плотности мощности, а также к снижению пассивирования при высоких скоростях разряда [20].Пористая структура электрода обеспечивает более высокую плотность энергии за счет короткой длины переноса ионов и легкой реакции переноса заряда на границе раздела электрод-электролит [39–42]. Поэтому желательна большая площадь поверхности цинкового электрода, так как она должна улучшить характеристики батареи за счет обеспечения увеличенной длины пути для переноса электронов и ионов Zn, площади контакта электрода / электролита и компенсации напряжения при введении / извлечении ионов Zn [43 , 44].
 Площадь поверхности порошков ZnO, использованных в этом исследовании, была рассчитана методом Барретта-Джойнера-Халенды (BJH).Сферический порошок ZnO, синтезированный из ZnCl 2 , имеет большую площадь поверхности 26,05 м 2 г -1 по сравнению с пластинчатым порошком ZnO, синтезированным из Zn (NO 3 ) 2 · 6H 2 O (11,00 м 2 г -1 ) и технический порошок ZnO (0,11 м 2 г -1 ). Эти результаты ниже, чем указанные в литературе значения, 38,9 м 2 г -1 для порошка ZnO, синтезированного из ZnCl 2, и 27.22 м 2 г −1 для порошка ZnO, синтезированного из Zn (NO 3 ) 2 · 6H 2 O [34, 35]. Однако эти различия можно объяснить вариациями параметров синтеза (концентрации, температуры, времени старения и т. Д.).
Площадь поверхности порошков ZnO, использованных в этом исследовании, была рассчитана методом Барретта-Джойнера-Халенды (BJH).Сферический порошок ZnO, синтезированный из ZnCl 2 , имеет большую площадь поверхности 26,05 м 2 г -1 по сравнению с пластинчатым порошком ZnO, синтезированным из Zn (NO 3 ) 2 · 6H 2 O (11,00 м 2 г -1 ) и технический порошок ZnO (0,11 м 2 г -1 ). Эти результаты ниже, чем указанные в литературе значения, 38,9 м 2 г -1 для порошка ZnO, синтезированного из ZnCl 2, и 27.22 м 2 г −1 для порошка ZnO, синтезированного из Zn (NO 3 ) 2 · 6H 2 O [34, 35]. Однако эти различия можно объяснить вариациями параметров синтеза (концентрации, температуры, времени старения и т. Д.).Чтобы исследовать влияние исходной морфологии порошка ZnO на электрохимические характеристики, призматические NiZn батареи заряжались и разряжались непрерывно.
 Один комплект батарей был разобран после третьего разряда для оценки изменения морфологии цинкового электрода.Во время разряда батареи ионы OH — возле электрода реагируют с цинком с образованием растворимого иона цинката (). Оксид цинка образуется из иона цинката в водном электролите при достижении предела растворимости. Точный продукт окисления цинка сильно зависит от значения pH раствора. Однако в условиях испытаний, использованных в данном исследовании, пассивирующий оксидный слой, который значительно снижает емкость, не должен существовать на поверхности цинкового электрода во время разряда [45, 46].
Один комплект батарей был разобран после третьего разряда для оценки изменения морфологии цинкового электрода.Во время разряда батареи ионы OH — возле электрода реагируют с цинком с образованием растворимого иона цинката (). Оксид цинка образуется из иона цинката в водном электролите при достижении предела растворимости. Точный продукт окисления цинка сильно зависит от значения pH раствора. Однако в условиях испытаний, использованных в данном исследовании, пассивирующий оксидный слой, который значительно снижает емкость, не должен существовать на поверхности цинкового электрода во время разряда [45, 46].Микроструктура и морфология поверхности цинкового электрода, содержащего порошок ZnO, синтезированный из ZnCl 2 (образец А1), показаны на рисунке 4 (а).На рис. 4 (б) показана морфология того же цинкового электрода после третьего разряда. Всего после трех циклов заряда / разряда было обнаружено, что морфология цинкового электрода отличается от исходного материала как по форме, так и по размеру частиц и пористости.
 Наносферы ZnO были в основном заменены большими пластинами ZnO и некоторыми игольчатыми частицами ZnO. Эволюция микроструктуры цинкового электрода, приготовленного с использованием порошка ZnO, синтезированного из Zn (NO 3 ) 2 · 6H 2 O (Образец B1) до первой зарядки и после третьего разряда, показана на рисунке 5.Как и в случае с образцом A1, морфология образца B1 после третьего разряда резко отличалась от его первоначальной морфологии. Пластинчатые частицы ZnO, видимые в свежеприготовленном образце, были преобразованы в иглы и проволоку микрометрового размера, как показано на рисунке 5 (b). Кроме того, в некоторых крупных призматических кристаллах ZnO также наблюдались размеры в несколько микрометров. Наконец, на рис. 6 показаны СЭМ-изображения образца C1, приготовленного с использованием коммерческого ZnO в исходном состоянии и после третьего разряда. Опять же, окончательная морфология электрода после третьего разряда оказалась очень отличной от морфологии исходного электрода.
Наносферы ZnO были в основном заменены большими пластинами ZnO и некоторыми игольчатыми частицами ZnO. Эволюция микроструктуры цинкового электрода, приготовленного с использованием порошка ZnO, синтезированного из Zn (NO 3 ) 2 · 6H 2 O (Образец B1) до первой зарядки и после третьего разряда, показана на рисунке 5.Как и в случае с образцом A1, морфология образца B1 после третьего разряда резко отличалась от его первоначальной морфологии. Пластинчатые частицы ZnO, видимые в свежеприготовленном образце, были преобразованы в иглы и проволоку микрометрового размера, как показано на рисунке 5 (b). Кроме того, в некоторых крупных призматических кристаллах ZnO также наблюдались размеры в несколько микрометров. Наконец, на рис. 6 показаны СЭМ-изображения образца C1, приготовленного с использованием коммерческого ZnO в исходном состоянии и после третьего разряда. Опять же, окончательная морфология электрода после третьего разряда оказалась очень отличной от морфологии исходного электрода. После третьего разряда очень большие кристаллы ZnO, которые также наблюдались в других образцах, покрывали большую часть поверхности электрода. Однако, в отличие от других образцов, нанопроволоки или наностержни ZnO или каких-либо признаков дендритного роста цинка не наблюдались.
После третьего разряда очень большие кристаллы ZnO, которые также наблюдались в других образцах, покрывали большую часть поверхности электрода. Однако, в отличие от других образцов, нанопроволоки или наностержни ZnO или каких-либо признаков дендритного роста цинка не наблюдались.Следует отметить, что первоначальная и последующая зарядка NiZn аккумуляторов не полностью превращает оксид цинка в металлический цинк, и всегда остается некоторое количество непрореагировавшего порошка ZnO. Поэтому при производстве коммерческих NiZn аккумуляторов обычной практикой является использование порошка ZnO по крайней мере на 10% больше, чем требуется для желаемой емкости.Типичные кривые разряда NiZn аккумуляторов показаны на рисунке 7. Следует еще раз отметить, что общее количество ZnO составляет 3 г для каждого цинкового электрода (и всего 6 г для одного NiZn аккумулятора) с теоретической удельной емкостью 978 мАч г -1 [47–49]. Поскольку сепаратор, концентрация электролита, емкость никелевого электрода и все другие экспериментальные параметры одинаковы, кривые «напряжение-емкость» дают ценную информацию об электрохимическом поведении цинкового электрода.
 Батареи с цинковыми электродами, приготовленными из коммерческого порошка ZnO (образец C1), показывают более медленное падение напряжения от начальной точки до примерно 1,35 В (плато разряда) перед резким падением напряжения, приводящим к более высокой разрядной емкости, 2,06 Ач, по сравнению с другими образцами с синтезированные порошки ZnO. В батареях NiZn с синтезированными порошками ZnO емкость образцов A1 и B1 была на 21% и 8% ниже соответственно. Все батареи показали одинаковую разрядку; однако среди множества подготовленных образцов батареи NiZn с коммерческими порошками ZnO неизменно показали более высокую разрядную емкость.При номинальном разрядном напряжении 1,6 В батареи NiZn с синтезированными порошками ZnO показали среднюю плотность энергии в диапазоне от 92 Втч кг -1 до 109 Втч кг -1 . Аккумуляторы NiZn с коммерческими порошками ZnO показали самую высокую удельную энергию, 118 Вт · ч · кг -1 .
Батареи с цинковыми электродами, приготовленными из коммерческого порошка ZnO (образец C1), показывают более медленное падение напряжения от начальной точки до примерно 1,35 В (плато разряда) перед резким падением напряжения, приводящим к более высокой разрядной емкости, 2,06 Ач, по сравнению с другими образцами с синтезированные порошки ZnO. В батареях NiZn с синтезированными порошками ZnO емкость образцов A1 и B1 была на 21% и 8% ниже соответственно. Все батареи показали одинаковую разрядку; однако среди множества подготовленных образцов батареи NiZn с коммерческими порошками ZnO неизменно показали более высокую разрядную емкость.При номинальном разрядном напряжении 1,6 В батареи NiZn с синтезированными порошками ZnO показали среднюю плотность энергии в диапазоне от 92 Втч кг -1 до 109 Втч кг -1 . Аккумуляторы NiZn с коммерческими порошками ZnO показали самую высокую удельную энергию, 118 Вт · ч · кг -1 .
Хотя эти средние значения плотности энергии относительно высоки, результаты несколько противоречат предыдущим исследованиям в литературе.
 Сообщалось, что с помощью порошков наночастиц ZnO с тщательно контролируемой морфологией в Zn-электродах можно получить высокую среднюю разрядную емкость для цинковых электродов.Например, электрохимическая активность нанопроволок ZnO со средней разрядной емкостью 609 мАч g -1 оказалась выше, чем у обычного ZnO [32]. В аналогичном исследовании начальная разрядная емкость полого веретенообразного ZnO и гексагонального конусообразного ZnO составила 476 мАч г -1 и 470 мАч г -1 , соответственно [33]. Однако о влиянии разрядной емкости цинкового электрода на плотность энергии батареи не сообщалось. Хотя значения плотности энергии призматических NiZn аккумуляторов, подготовленных в этом исследовании, намного выше, чем средние плотности энергии коммерчески доступных сегодня NiZn аккумуляторов, средняя разрядная емкость цинковых электродов варьируется от 270 до 345 мА г -1 , что намного ниже заявленных значений для нано порошки ZnO в литературе.
Сообщалось, что с помощью порошков наночастиц ZnO с тщательно контролируемой морфологией в Zn-электродах можно получить высокую среднюю разрядную емкость для цинковых электродов.Например, электрохимическая активность нанопроволок ZnO со средней разрядной емкостью 609 мАч g -1 оказалась выше, чем у обычного ZnO [32]. В аналогичном исследовании начальная разрядная емкость полого веретенообразного ZnO и гексагонального конусообразного ZnO составила 476 мАч г -1 и 470 мАч г -1 , соответственно [33]. Однако о влиянии разрядной емкости цинкового электрода на плотность энергии батареи не сообщалось. Хотя значения плотности энергии призматических NiZn аккумуляторов, подготовленных в этом исследовании, намного выше, чем средние плотности энергии коммерчески доступных сегодня NiZn аккумуляторов, средняя разрядная емкость цинковых электродов варьируется от 270 до 345 мА г -1 , что намного ниже заявленных значений для нано порошки ZnO в литературе. Кроме того, коммерческий порошок ZnO с наименьшей площадью поверхности (образец С1) показал лучшую разрядную способность и привел к более высокой плотности энергии. Очевидно, что более высокая площадь поверхности электрода или более высокая разрядная емкость электрода не обязательно означает более высокую плотность энергии для NiZn-аккумуляторов. Чтобы улучшить разрядную емкость электрода, необходимо синтезировать порошки нано ZnO с тщательно контролируемой морфологией, что обычно увеличивает стоимость производства. Другой подход к увеличению разрядной емкости электрода заключается в использовании гораздо более тонких электродов, но этот подход увеличивает вес батареи из-за большего токосъемника и сепаратора, что приводит к более низкой плотности энергии батареи.В отличие от предыдущих исследований, использование обычного порошка ZnO для цинковых электродов привело к лучшей циклической стабильности. Как видно на рисунке 8, цинковые электроды с промышленным порошком ZnO показали менее 3% потери емкости после 50 циклов по сравнению с 35% для образца A1 и 8% для образца B1, соответственно.
Кроме того, коммерческий порошок ZnO с наименьшей площадью поверхности (образец С1) показал лучшую разрядную способность и привел к более высокой плотности энергии. Очевидно, что более высокая площадь поверхности электрода или более высокая разрядная емкость электрода не обязательно означает более высокую плотность энергии для NiZn-аккумуляторов. Чтобы улучшить разрядную емкость электрода, необходимо синтезировать порошки нано ZnO с тщательно контролируемой морфологией, что обычно увеличивает стоимость производства. Другой подход к увеличению разрядной емкости электрода заключается в использовании гораздо более тонких электродов, но этот подход увеличивает вес батареи из-за большего токосъемника и сепаратора, что приводит к более низкой плотности энергии батареи.В отличие от предыдущих исследований, использование обычного порошка ZnO для цинковых электродов привело к лучшей циклической стабильности. Как видно на рисунке 8, цинковые электроды с промышленным порошком ZnO показали менее 3% потери емкости после 50 циклов по сравнению с 35% для образца A1 и 8% для образца B1, соответственно.
На этом этапе причина немного большей разрядной емкости и лучших разрядных характеристик цинковых электродов с промышленным порошком ZnO может быть интерпретирована только как связанная с морфологией порошка ZnO.В то же время изображения СЭМ показывают, что первоначальная морфология электродов резко меняется после нескольких циклов заряда / разряда.
В литературе сообщалось, что цинковые электроды, изготовленные из полых веретенообразных порошков ZnO и гексагональных конических порошков ZnO, демонстрируют и сохраняют высокую разрядную емкость по сравнению с обычным ZnO [33]. Было заявлено, что морфология и ориентация цинка полностью зависят от характеристик поверхности подложки, а остаточные полые веретенообразные порошки ZnO и гексагональные конусообразные порошки ZnO являются лучшими подложками, способствующими боковому росту кристалла активного материала параллельно подложке при зарядке [33] .Об аналогичном изменении морфологии цинковых электродов также сообщалось, когда электрохимические характеристики промышленного ZnO сравнивались с нанопроволокой ZnO и наноразмерным ZnO [8, 32].
 Вопреки выводам этого исследования, NiZn батареи, изготовленные из нанопроволоки и наноразмерного ZnO, как сообщалось, демонстрируют лучшую разрядную емкость и стабильность цикла, более высокое напряжение разряда и более низкое напряжение заряда. Лучшие электрохимические характеристики были объяснены эффектами подложки, электрохимической активностью частиц ZnO, толщиной электроосаждений и плотностью тока заряда / разряда, которые обычно благоприятствуют частицам нано ZnO в большинстве NiZn батарей [8].
Вопреки выводам этого исследования, NiZn батареи, изготовленные из нанопроволоки и наноразмерного ZnO, как сообщалось, демонстрируют лучшую разрядную емкость и стабильность цикла, более высокое напряжение разряда и более низкое напряжение заряда. Лучшие электрохимические характеристики были объяснены эффектами подложки, электрохимической активностью частиц ZnO, толщиной электроосаждений и плотностью тока заряда / разряда, которые обычно благоприятствуют частицам нано ZnO в большинстве NiZn батарей [8].Фактически, морфология цинкового электрода зависит от многих факторов, включая, помимо прочего, химические и физические свойства подложки, тип и концентрацию щелочного электролита, плотности тока заряда и разряда, пассивные и активные добавки в электроде и электролите, геометрию электрода, тип и загрузка связующего материала, температура и т. д. Небольшое изменение одного или нескольких из этих параметров может привести к различной морфологии электрода, что приведет к другим характеристикам разряда.
 Более низкие характеристики электродов с наноразмерным порошком ZnO по сравнению с электродами с промышленным порошком ZnO должны быть связаны с изменением морфологии цинкового электрода, так как все остальные параметры в этом исследовании остаются неизменными.
Более низкие характеристики электродов с наноразмерным порошком ZnO по сравнению с электродами с промышленным порошком ZnO должны быть связаны с изменением морфологии цинкового электрода, так как все остальные параметры в этом исследовании остаются неизменными.Как видно на рисунках 4–6, даже после нескольких циклов заряда / разряда морфология цинковых электродов отличается друг от друга, а также резко отличается от своей первоначальной морфологии. Цинковый электрод, приготовленный из обычных гексагональных частиц ZnO (Образец C1), показывает очень небольшое количество дендритного роста после циклов заряда / разряда в отличие от электродов с наноразмерными частицами ZnO (Образец A1 и Образец B1).Рост дендритов — одна из проблем, связанных с плохой работой цинковых электродов. Кроме того, указанные здесь площади поверхности представляют собой площади порошков ZnO, используемых для изготовления цинковых электродов. Поскольку после нескольких циклов заряда / разряда морфология электродов резко меняется, стирая исходную морфологию электродов, фактическая площадь поверхности цинкового электрода, доступная для электрохимических реакций, и пористость будут отличаться по мере увеличения количества циклов.
 Мы подозреваем, что исходный состав электродов и условия заряда / разряда, использованные в этом исследовании, приводят к изменению морфологии, при котором перенос массы цинката ограничивается диффузией, что приводит к росту дендритов при зарядке и, следовательно, к потере емкости для Образца A1 и Образца B1, батарей с цинком. электроды, изготовленные из порошков нано ZnO.
Мы подозреваем, что исходный состав электродов и условия заряда / разряда, использованные в этом исследовании, приводят к изменению морфологии, при котором перенос массы цинката ограничивается диффузией, что приводит к росту дендритов при зарядке и, следовательно, к потере емкости для Образца A1 и Образца B1, батарей с цинком. электроды, изготовленные из порошков нано ZnO.Исследования наноразмерных порошков ZnO в качестве электродных материалов, демонстрирующих высокую разрядную емкость электродов, обычно включают другие добавки в электродных структурах, такие как порошки фторполимеров, графит, ацетиленовая сажа, SnO, In 2 O 3 и карбоксиметилцеллюлоза. Кроме того, K 2 BO 3 , KF, LiOH и NaOH также широко используются в качестве добавок к щелочным электролитам [32, 33]. Тип и количество добавок в электроде и электролите сильно влияют на электрохимические реакции и, следовательно, на морфологию электродов.Следует отметить, что цинковые электроды, использованные в этом исследовании, были приготовлены из порошка оксида цинка с небольшими количествами гидроксида кальция, оксида свинца (II), целлюлозы и PEG.
 Также в электролите KOH не было добавок, упрощающих химию. Возможно, что отсутствие добавок, которые, как было доказано, улучшают разрядную емкость цинкового электрода, является причиной более низкой разрядной емкости, указанной здесь.
Также в электролите KOH не было добавок, упрощающих химию. Возможно, что отсутствие добавок, которые, как было доказано, улучшают разрядную емкость цинкового электрода, является причиной более низкой разрядной емкости, указанной здесь.4. Выводы
На характеристики NiZn-аккумулятора влияет множество факторов, таких как геометрия аккумулятора, сепаратор, тип и концентрация электролита, пористость электродов, выделение газа, начальные условия зарядки и плотность тока разряда.Например, разница между средней разрядной емкостью цинковых электродов становится меньше, а использование материалов увеличивается по мере уменьшения плотности тока разряда. Исходная морфология цинкового электрода, по-видимому, играет роль в производительности батареи, но неясно, когда эффект начальной морфологии преобладает в характеристиках батареи. Поэтому особое внимание следует уделять конструкции элемента и параметрам заряда / разряда при сравнении влияния исходной морфологии порошка ZnO на характеристики батареи.
Исходный состав цинковых электродов и условия испытаний батарей (плотности тока заряда и разряда), использованные в этом исследовании, вероятно, являются причинами более низкой разрядной емкости для цинковых электродов, изготовленных из наноразмерных порошков ZnO, по сравнению со значениями, указанными в литературе. Очевидно, что первоначальная морфология цинкового электрода влияет на разрядную емкость электрода, но это может быть не так важно, как можно было бы подумать, для плотности энергии батареи. Однако определенные морфологии, подавляющие рост дендритов цинка при зарядке, безусловно, увеличивают срок службы NiZn аккумуляторов.
Пассивация и короткое замыкание являются основными причинами ограниченного срока службы NiZn аккумуляторов, но слишком часто трудно определить, какая из них ответственна за потерю емкости. Сепаратор, который подавляет рост дендритного цинка и предотвращает короткое замыкание батареи, в сочетании с электролитом с низкой растворимостью цинката также необходим для увеличения срока службы и емкости.
Основная часть исследований, связанных с NiZn батареями, сосредоточена на улучшении характеристик цинкового электрода за счет увеличения разрядной емкости электрода, уменьшения пассивации, уменьшения изменения формы и подавления дендритного роста цинка.Хотя подавление дендритного роста цинка во время зарядки для минимизации возможности короткого замыкания и уменьшения пассивирования необходимо, улучшение разрядной емкости цинкового электрода может не потребоваться для достижения удельной энергии NiZn батареи более 100 Вт · ч кг -1 , как показано в этом исследовании. . Интересно, что на рынке не было никаких коммерческих NiZn аккумуляторов с плотностью энергии более 100 Вт · ч кг -1 , хотя были изготовлены цинковые электроды с чрезвычайно высокой разрядной емкостью.Избыточный вес и производственные затраты, связанные с этими высокоэффективными цинковыми электродами, являются основными препятствиями для коммерциализации. Следовательно, критерии плотности разряда электродов следует использовать с осторожностью.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов относительно публикации этой статьи.
Благодарности
Авторы благодарны доктору Огану Очали и профессору доктору Мухсину Чифтчиоглу за их ценные советы, комментарии и обсуждения.Они благодарят Ocalı A. S. за финансовую поддержку для выполнения этой работы.
Цинк
Химический элемент цинк относится к переходным металлам. Это известно с давних времен. Его первооткрыватель и дата открытия неизвестны.
Зона данных
Показать еще: Теплота, энергия, окисление,Классификация: Цинк — переходный металл Цвет: голубовато-серебристый Атомный вес: 65,41 Состояние: цельный Температура плавления: 419.53 o С, 692,68 К Температура кипения: 910 o C, 1183 K Электронов: 30 Протоны: 30 Нейтроны в наиболее распространенном изотопе: 34 Электронные оболочки: 2,8,18,2 Электронная конфигурация: [Ар] 3d 10 4s 2 Плотность при 20 o C: 7.14 г / см 3
реакции, соединения, радиусы, проводимостиАтомный объем: 9,2 см 3 / моль Состав: hcp: гексагональный плотно упакованный Твердость: 2,5 МОС Удельная теплоемкость 0,39 Дж г -1 K -1 Теплота плавления 7.322 кДж моль -1 Теплота распыления 131 кДж моль -1 Теплота испарения 115,30 кДж моль -1 1 st энергия ионизации 906,4 кДж моль -1 > 2 nd энергия ионизации 1733,2 кДж моль -1 3 rd энергия ионизации 3832.6 кДж моль -1 Сродство к электрону – Минимальная степень окисления 0 Мин. общее окисление нет. 0 Максимальное число окисления 2 Макс. общее окисление нет. 2 Электроотрицательность (шкала Полинга) 1,65 Объем поляризуемости 6.4 Å 3 Реакция с воздухом сильнорослый, ⇒ ZnO Реакция с 15 M HNO 3 сильнодействующий, ⇒ Zn (NO 3 ) 2 , NO x Реакция с 6 M HCl мягкий, ⇒ H 2 , ZnCl 2 Реакция с 6 М NaOH мягкий, ⇒ [Zn (OH 4 )] 2- , H 2 Оксид (ов) ZnO, ZnO 2 (пероксид цинка) Гидрид (ы) ZnH 2 Хлорид (ы) ZnCl 2 Атомный радиус 135 вечера Ионный радиус (1+ ион) – Ионный радиус (2+ ионов) 88 вечера Ионный радиус (3+ ионов) – Ионный радиус (1-ионный) – Ионный радиус (2-ионный) – Ионный радиус (3-ионный) – Теплопроводность 116 Вт м -1 К -1 Электропроводность 16.9 x 10 6 S м -1 Температура замерзания / плавления: 419,53 o С, 692,68 К Батареи — внешняя часть этих батарей сделана из цинка — цинк действует как электрод батареи и контейнер.
Цинк очень активно реагирует с серой. Вот пробный пуск серо-цинковой ракеты.
Реакция цинка с йодом.
Открытие цинка
Цинковые руды использовались для изготовления латуни (смеси меди и цинка) и других сплавов с древних времен.
Цинковый сплав, содержащий 87,5% цинка, был обнаружен на древнем месте в Трансильвании.
Плавка цинка началась в 12 веке в Индии путем восстановления каламина (карбонат цинка, ZnCO 3 ) шерстью и другими органическими материалами.
 Перед обработкой его дополнительно окунают в раствор кислоты;
Перед обработкой его дополнительно окунают в раствор кислоты;

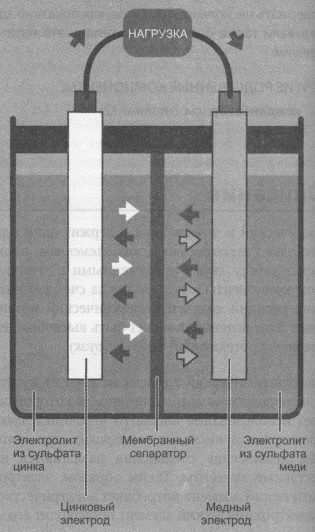
 Происходит преобразование химической потенциальной энергии в электрическую потенциальную энергию, электрическую потенциальную энергию или в химическую потенциальную энергию.
Происходит преобразование химической потенциальной энергии в электрическую потенциальную энергию, электрическую потенциальную энергию или в химическую потенциальную энергию.

 Оставить постоять примерно на сутки.
Оставить постоять примерно на сутки.
 {-} \) \ (\ to \) \ (\ text {Cu} (\ text {s}) \). Восстановление происходит на медном электроде.
{-} \) \ (\ to \) \ (\ text {Cu} (\ text {s}) \). Восстановление происходит на медном электроде. В 1780 году Гальвани обнаружил, что когда два разных металла (например, медь и цинк) были соединены друг с другом, а затем оба одновременно касались разных частей нерва лягушачьей ноги, они заставляли ногу сокращаться. Он назвал это «животным электричеством».
В 1780 году Гальвани обнаружил, что когда два разных металла (например, медь и цинк) были соединены друг с другом, а затем оба одновременно касались разных частей нерва лягушачьей ноги, они заставляли ногу сокращаться. Он назвал это «животным электричеством».
 Этот процесс называется электролиз .
Этот процесс называется электролиз .
 Исследовано влияние исходной морфологии цинкового электрода на емкость аккумулятора. Сканирующая электронная микроскопия (SEM) и дифракция рентгеновских лучей (XRD) показывают, что первоначальная морфология цинкового электрода резко меняется после нескольких циклов зарядки / разрядки независимо от исходного использованного порошка ZnO. Электроды ZnO, полученные с использованием порошков ZnO, синтезированных из ZnCl 2 и Zn (NO 3 ) 2 , приводят к средней плотности энергии батареи в диапазоне от 92 Втч кг -1 до 109 Втч кг -1 при использовании обычного ZnO порошок приводит к более высокой плотности энергии, 118 Втч кг -1 .Средняя разрядная емкость цинковых электродов варьируется от 270 до 345 мА г -1 , что намного ниже, чем значения, указанные в литературе для порошков нано ZnO. Более высокая площадь поверхности электрода или более высокая разрядная емкость электрода не обязательно означает более высокую плотность энергии батареи.
Исследовано влияние исходной морфологии цинкового электрода на емкость аккумулятора. Сканирующая электронная микроскопия (SEM) и дифракция рентгеновских лучей (XRD) показывают, что первоначальная морфология цинкового электрода резко меняется после нескольких циклов зарядки / разрядки независимо от исходного использованного порошка ZnO. Электроды ZnO, полученные с использованием порошков ZnO, синтезированных из ZnCl 2 и Zn (NO 3 ) 2 , приводят к средней плотности энергии батареи в диапазоне от 92 Втч кг -1 до 109 Втч кг -1 при использовании обычного ZnO порошок приводит к более высокой плотности энергии, 118 Втч кг -1 .Средняя разрядная емкость цинковых электродов варьируется от 270 до 345 мА г -1 , что намного ниже, чем значения, указанные в литературе для порошков нано ZnO. Более высокая площадь поверхности электрода или более высокая разрядная емкость электрода не обязательно означает более высокую плотность энергии батареи.
 Среди этих проблем — изменение формы цинкового электрода с увеличением количества циклов заряда / разряда, пассивация цинкового электрода и дендритный рост цинка, ведущий к короткому замыканию батареи. В процессе разряда цинк растворяется в виде иона цинката () в щелочном электролите до того, как оксид цинка осаждается. Высокоподвижные ионы цинката концентрируются около дна электрода и выпадают в осадок в виде оксида цинка, когда достигается предел растворимости.Этот процесс приводит к неоднородности толщины осажденного цинка на электроде с увеличением количества циклов зарядки / разрядки и, в сочетании с дендритным ростом цинка во время зарядки, в конечном итоге вызывает короткое замыкание аккумулятора. Пассивация также считается одной из серьезных причин износа цинковых батарей. Это явление происходит, когда растворение цинка создает ситуацию, в которой достигается предел растворимости цинката в электролите вблизи поверхности цинкового электрода, и на поверхности электрода образуется изолирующий слой оксида цинка.
Среди этих проблем — изменение формы цинкового электрода с увеличением количества циклов заряда / разряда, пассивация цинкового электрода и дендритный рост цинка, ведущий к короткому замыканию батареи. В процессе разряда цинк растворяется в виде иона цинката () в щелочном электролите до того, как оксид цинка осаждается. Высокоподвижные ионы цинката концентрируются около дна электрода и выпадают в осадок в виде оксида цинка, когда достигается предел растворимости.Этот процесс приводит к неоднородности толщины осажденного цинка на электроде с увеличением количества циклов зарядки / разрядки и, в сочетании с дендритным ростом цинка во время зарядки, в конечном итоге вызывает короткое замыкание аккумулятора. Пассивация также считается одной из серьезных причин износа цинковых батарей. Это явление происходит, когда растворение цинка создает ситуацию, в которой достигается предел растворимости цинката в электролите вблизи поверхности цинкового электрода, и на поверхности электрода образуется изолирующий слой оксида цинка. В результате этого короткий срок службы и / или плохие электрохимические характеристики ограничивают масштабное внедрение NiZn батарей [3, 6–8]. Некоторые из этих проблем прямо или косвенно связаны с образованием растворимых ионов цинката в щелочном растворе во время работы от батареи. Предел растворимости цинката определяется температурой и pH щелочного раствора. Было предпринято множество попыток минимизировать растворимость и перемещение продуктов окисления цинка в щелочных растворах и улучшить физическую и химическую стабильность цинкового электрода при увеличении числа циклов заряда / разряда.Эти попытки включают, но не ограничиваются ими, использование органических и неорганических добавок в цинковых электродах и электролите, настройку структуры сепаратора для минимизации роста дендритного цинка [9, 10] и использование электродов различной геометрии [11, 12]. Одним из эффективных способов минимизировать указанные выше проблемы является использование различных оксидных добавок, таких как Ca (OH) 2 [13, 14], Bi 2 O 3 [15], PbO [16], TiO 2 [17] и In 2 O 3 [18] в цинковом электроде.
В результате этого короткий срок службы и / или плохие электрохимические характеристики ограничивают масштабное внедрение NiZn батарей [3, 6–8]. Некоторые из этих проблем прямо или косвенно связаны с образованием растворимых ионов цинката в щелочном растворе во время работы от батареи. Предел растворимости цинката определяется температурой и pH щелочного раствора. Было предпринято множество попыток минимизировать растворимость и перемещение продуктов окисления цинка в щелочных растворах и улучшить физическую и химическую стабильность цинкового электрода при увеличении числа циклов заряда / разряда.Эти попытки включают, но не ограничиваются ими, использование органических и неорганических добавок в цинковых электродах и электролите, настройку структуры сепаратора для минимизации роста дендритного цинка [9, 10] и использование электродов различной геометрии [11, 12]. Одним из эффективных способов минимизировать указанные выше проблемы является использование различных оксидных добавок, таких как Ca (OH) 2 [13, 14], Bi 2 O 3 [15], PbO [16], TiO 2 [17] и In 2 O 3 [18] в цинковом электроде. Эти добавки могут снизить концентрацию продуктов окисления цинка и улучшить электронную проводимость и распределение тока [14]. Связующие вещества или гели, такие как силикат натрия [19], тапиока [20], политетрафторэтилен [21, 22], гель Carbopol [23, 24] и саго, который представляет собой крахмал, экстрагированный из стеблей пальмы [25], использовались для увеличения использование активного материала и эффективная площадь поверхности цинкового электрода. Сообщалось, что добавление силиката натрия в качестве связующего увеличивает производительность батареи [19].Также сообщалось, что использование крахмала тапиоки в качестве связующего для пористого цинкового электрода увеличивает удельную емкость [20]. В щелочных растворах в качестве ингибиторов коррозии цинка используются различные органические добавки. Некоторые из них либо дороги, либо токсичны и не безвредны для окружающей среды, что ограничивает их использование в батареях. Одним из немногих нетоксичных и дешевых органических материалов является полиэтиленгликоль (ПЭГ) [26, 27].
Эти добавки могут снизить концентрацию продуктов окисления цинка и улучшить электронную проводимость и распределение тока [14]. Связующие вещества или гели, такие как силикат натрия [19], тапиока [20], политетрафторэтилен [21, 22], гель Carbopol [23, 24] и саго, который представляет собой крахмал, экстрагированный из стеблей пальмы [25], использовались для увеличения использование активного материала и эффективная площадь поверхности цинкового электрода. Сообщалось, что добавление силиката натрия в качестве связующего увеличивает производительность батареи [19].Также сообщалось, что использование крахмала тапиоки в качестве связующего для пористого цинкового электрода увеличивает удельную емкость [20]. В щелочных растворах в качестве ингибиторов коррозии цинка используются различные органические добавки. Некоторые из них либо дороги, либо токсичны и не безвредны для окружающей среды, что ограничивает их использование в батареях. Одним из немногих нетоксичных и дешевых органических материалов является полиэтиленгликоль (ПЭГ) [26, 27]. Было обнаружено, что ингибирующая коррозия способность ПЭГ превосходит кислотную форму полиоксиэтиленалкилфосфатного эфира при использовании в цинковом электроде [27, 28].Хотя частично успешные, ни одна из описанных в литературе попыток не предоставила окончательного решения проблемы короткого срока службы и плохой работы цинкового электрода из-за изменения формы и короткого замыкания в результате роста дендритного цинка во время зарядки.
Было обнаружено, что ингибирующая коррозия способность ПЭГ превосходит кислотную форму полиоксиэтиленалкилфосфатного эфира при использовании в цинковом электроде [27, 28].Хотя частично успешные, ни одна из описанных в литературе попыток не предоставила окончательного решения проблемы короткого срока службы и плохой работы цинкового электрода из-за изменения формы и короткого замыкания в результате роста дендритного цинка во время зарядки. Например, Yang et al. исследовали нанопроволоки ZnO, синтезированные гидротермальным методом, в качестве электродного материала [32]. Сообщалось, что структуры нанопроволоки ломались и превращались в наностержни во время циклов зарядки / разрядки и подавляли рост дендритного цинка.Использование призматического ZnO, синтезированного путем гомогенного осаждения, в качестве электродного материала исследовали Yuan et al. [8]. Результаты показали, что напряжение разряда в средней точке, стабильность цикла и устойчивость к пассивации были улучшены по сравнению с коммерческим ZnO с типичными гексагональными призматическими частицами. Юань и его коллеги подробно изучили влияние морфологии и размера ZnO на характеристики цинкового электрода [6]. По сравнению с другими морфологиями частицы ZnO с наностержнями демонстрируют лучшую стабильность электрохимического цикла и характеристики заряда / разряда.Их результаты показали, что обычные гексагональные частицы ZnO превращаются в чешуйчатые кристаллы, что снижает производительность.
Например, Yang et al. исследовали нанопроволоки ZnO, синтезированные гидротермальным методом, в качестве электродного материала [32]. Сообщалось, что структуры нанопроволоки ломались и превращались в наностержни во время циклов зарядки / разрядки и подавляли рост дендритного цинка.Использование призматического ZnO, синтезированного путем гомогенного осаждения, в качестве электродного материала исследовали Yuan et al. [8]. Результаты показали, что напряжение разряда в средней точке, стабильность цикла и устойчивость к пассивации были улучшены по сравнению с коммерческим ZnO с типичными гексагональными призматическими частицами. Юань и его коллеги подробно изучили влияние морфологии и размера ZnO на характеристики цинкового электрода [6]. По сравнению с другими морфологиями частицы ZnO с наностержнями демонстрируют лучшую стабильность электрохимического цикла и характеристики заряда / разряда.Их результаты показали, что обычные гексагональные частицы ZnO превращаются в чешуйчатые кристаллы, что снижает производительность.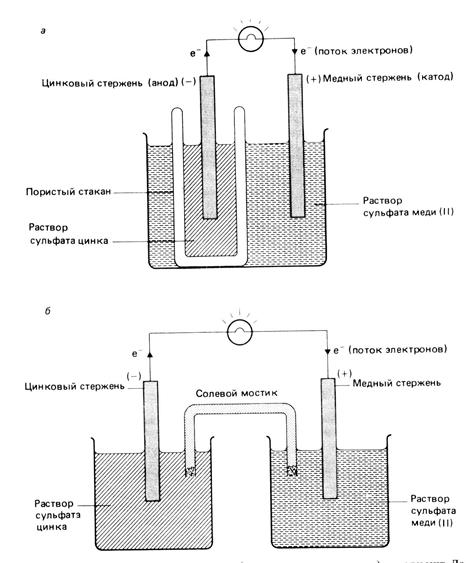 Вен и его коллеги сообщили, что электрохимические характеристики полого сплава ZnO и гексагонального конусообразного ZnO, полученного гидротермальным методом, были лучше по сравнению с обычным ZnO в качестве анодных материалов для ячеек NiZn, а полые частицы ZnO, полученные методом плавления, показали лучшую стабильность электрохимического цикла и заряд. разрядная производительность [33].
Вен и его коллеги сообщили, что электрохимические характеристики полого сплава ZnO и гексагонального конусообразного ZnO, полученного гидротермальным методом, были лучше по сравнению с обычным ZnO в качестве анодных материалов для ячеек NiZn, а полые частицы ZnO, полученные методом плавления, показали лучшую стабильность электрохимического цикла и заряд. разрядная производительность [33]. В дополнение к коммерческому порошку ZnO, полученному механохимическими методами при повышенных температурах (Киметсан, 99%), были синтезированы два других порошка ZnO с различной морфологией, как описано ниже.
В дополнение к коммерческому порошку ZnO, полученному механохимическими методами при повышенных температурах (Киметсан, 99%), были синтезированы два других порошка ZnO с различной морфологией, как описано ниже.
 Пасту цинкового электрода готовили путем механического смешивания 3 г порошка оксида цинка, 0,03 г гидроксида кальция и 0,08 г оксида свинца (II) с предварительно приготовленными 1 мл 10% -ного раствора PEG и 1,6 мл 6 M растворов KOH, содержащих 0,35 г растворенной целлюлозы. Затем пасту наносили на одну сторону оловянного никелевого токосъемника толщиной мкм толщиной м с использованием трафарета для формирования однородного слоя. Наклеенные Ni (OH) 2 электродов с удвоенной емкостью электродов из цинка использовали, чтобы убедиться, что емкость батареи не ограничивается никелевым электродом.Ni электродную пасту наносили на обе стороны токосъемника из никелевой фольги с помощью трафарета. Коммерческие сепараторы на основе целлюлозы (Ocalı A. S.) обильно смачивали 6 М КОН перед тем, как их поместили между электродами из никеля и цинка. Полученная структура электрода Zn / Ni / Zn была плотно закрыта между двумя пластинами слюды под давлением. Батареи NiZn с цинковыми электродами, имеющими сферические частицы ZnO, синтезированные из ZnCl 2 (образец преобладает A1), пластина , -подобные частицы ZnO, синтезированные Zn (NO 3 ) 2 (образец B1), и коммерческий порошок ZnO (образец C1) были приготовлены по тому же рецепту.
Пасту цинкового электрода готовили путем механического смешивания 3 г порошка оксида цинка, 0,03 г гидроксида кальция и 0,08 г оксида свинца (II) с предварительно приготовленными 1 мл 10% -ного раствора PEG и 1,6 мл 6 M растворов KOH, содержащих 0,35 г растворенной целлюлозы. Затем пасту наносили на одну сторону оловянного никелевого токосъемника толщиной мкм толщиной м с использованием трафарета для формирования однородного слоя. Наклеенные Ni (OH) 2 электродов с удвоенной емкостью электродов из цинка использовали, чтобы убедиться, что емкость батареи не ограничивается никелевым электродом.Ni электродную пасту наносили на обе стороны токосъемника из никелевой фольги с помощью трафарета. Коммерческие сепараторы на основе целлюлозы (Ocalı A. S.) обильно смачивали 6 М КОН перед тем, как их поместили между электродами из никеля и цинка. Полученная структура электрода Zn / Ni / Zn была плотно закрыта между двумя пластинами слюды под давлением. Батареи NiZn с цинковыми электродами, имеющими сферические частицы ZnO, синтезированные из ZnCl 2 (образец преобладает A1), пластина , -подобные частицы ZnO, синтезированные Zn (NO 3 ) 2 (образец B1), и коммерческий порошок ZnO (образец C1) были приготовлены по тому же рецепту. Схема призматических батарей, в которых никелевый электрод помещен между двумя цинковыми электродами, показана на рисунке 1.
Схема призматических батарей, в которых никелевый электрод помещен между двумя цинковыми электродами, показана на рисунке 1. Все испытания проводились при комнатной температуре. Зарядка призматических NiZn аккумуляторов выполнялась при фиксированном напряжении (1,94 В) до тех пор, пока зарядный ток не упал до 0,01 А. Испытания на разряд проводились при фиксированном токе 0,8 А до тех пор, пока напряжение аккумулятора не упало до 1,0 В.
Все испытания проводились при комнатной температуре. Зарядка призматических NiZn аккумуляторов выполнялась при фиксированном напряжении (1,94 В) до тех пор, пока зарядный ток не упал до 0,01 А. Испытания на разряд проводились при фиксированном токе 0,8 А до тех пор, пока напряжение аккумулятора не упало до 1,0 В.
 На рисунке 3 (c) наблюдается широкий диапазон распределения частиц по размерам со смесью пластин, стержней и призматических частиц длиной до нескольких микрометров.
На рисунке 3 (c) наблюдается широкий диапазон распределения частиц по размерам со смесью пластин, стержней и призматических частиц длиной до нескольких микрометров. Площадь поверхности порошков ZnO, использованных в этом исследовании, была рассчитана методом Барретта-Джойнера-Халенды (BJH).Сферический порошок ZnO, синтезированный из ZnCl 2 , имеет большую площадь поверхности 26,05 м 2 г -1 по сравнению с пластинчатым порошком ZnO, синтезированным из Zn (NO 3 ) 2 · 6H 2 O (11,00 м 2 г -1 ) и технический порошок ZnO (0,11 м 2 г -1 ). Эти результаты ниже, чем указанные в литературе значения, 38,9 м 2 г -1 для порошка ZnO, синтезированного из ZnCl 2, и 27.22 м 2 г −1 для порошка ZnO, синтезированного из Zn (NO 3 ) 2 · 6H 2 O [34, 35]. Однако эти различия можно объяснить вариациями параметров синтеза (концентрации, температуры, времени старения и т. Д.).
Площадь поверхности порошков ZnO, использованных в этом исследовании, была рассчитана методом Барретта-Джойнера-Халенды (BJH).Сферический порошок ZnO, синтезированный из ZnCl 2 , имеет большую площадь поверхности 26,05 м 2 г -1 по сравнению с пластинчатым порошком ZnO, синтезированным из Zn (NO 3 ) 2 · 6H 2 O (11,00 м 2 г -1 ) и технический порошок ZnO (0,11 м 2 г -1 ). Эти результаты ниже, чем указанные в литературе значения, 38,9 м 2 г -1 для порошка ZnO, синтезированного из ZnCl 2, и 27.22 м 2 г −1 для порошка ZnO, синтезированного из Zn (NO 3 ) 2 · 6H 2 O [34, 35]. Однако эти различия можно объяснить вариациями параметров синтеза (концентрации, температуры, времени старения и т. Д.). Один комплект батарей был разобран после третьего разряда для оценки изменения морфологии цинкового электрода.Во время разряда батареи ионы OH — возле электрода реагируют с цинком с образованием растворимого иона цинката (). Оксид цинка образуется из иона цинката в водном электролите при достижении предела растворимости. Точный продукт окисления цинка сильно зависит от значения pH раствора. Однако в условиях испытаний, использованных в данном исследовании, пассивирующий оксидный слой, который значительно снижает емкость, не должен существовать на поверхности цинкового электрода во время разряда [45, 46].
Один комплект батарей был разобран после третьего разряда для оценки изменения морфологии цинкового электрода.Во время разряда батареи ионы OH — возле электрода реагируют с цинком с образованием растворимого иона цинката (). Оксид цинка образуется из иона цинката в водном электролите при достижении предела растворимости. Точный продукт окисления цинка сильно зависит от значения pH раствора. Однако в условиях испытаний, использованных в данном исследовании, пассивирующий оксидный слой, который значительно снижает емкость, не должен существовать на поверхности цинкового электрода во время разряда [45, 46].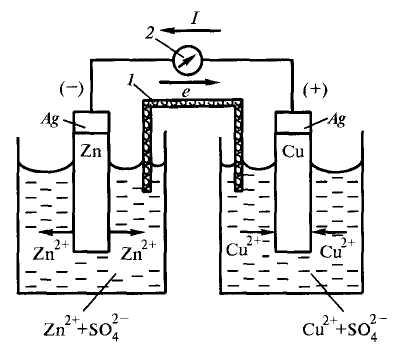 Наносферы ZnO были в основном заменены большими пластинами ZnO и некоторыми игольчатыми частицами ZnO. Эволюция микроструктуры цинкового электрода, приготовленного с использованием порошка ZnO, синтезированного из Zn (NO 3 ) 2 · 6H 2 O (Образец B1) до первой зарядки и после третьего разряда, показана на рисунке 5.Как и в случае с образцом A1, морфология образца B1 после третьего разряда резко отличалась от его первоначальной морфологии. Пластинчатые частицы ZnO, видимые в свежеприготовленном образце, были преобразованы в иглы и проволоку микрометрового размера, как показано на рисунке 5 (b). Кроме того, в некоторых крупных призматических кристаллах ZnO также наблюдались размеры в несколько микрометров. Наконец, на рис. 6 показаны СЭМ-изображения образца C1, приготовленного с использованием коммерческого ZnO в исходном состоянии и после третьего разряда. Опять же, окончательная морфология электрода после третьего разряда оказалась очень отличной от морфологии исходного электрода.
Наносферы ZnO были в основном заменены большими пластинами ZnO и некоторыми игольчатыми частицами ZnO. Эволюция микроструктуры цинкового электрода, приготовленного с использованием порошка ZnO, синтезированного из Zn (NO 3 ) 2 · 6H 2 O (Образец B1) до первой зарядки и после третьего разряда, показана на рисунке 5.Как и в случае с образцом A1, морфология образца B1 после третьего разряда резко отличалась от его первоначальной морфологии. Пластинчатые частицы ZnO, видимые в свежеприготовленном образце, были преобразованы в иглы и проволоку микрометрового размера, как показано на рисунке 5 (b). Кроме того, в некоторых крупных призматических кристаллах ZnO также наблюдались размеры в несколько микрометров. Наконец, на рис. 6 показаны СЭМ-изображения образца C1, приготовленного с использованием коммерческого ZnO в исходном состоянии и после третьего разряда. Опять же, окончательная морфология электрода после третьего разряда оказалась очень отличной от морфологии исходного электрода. После третьего разряда очень большие кристаллы ZnO, которые также наблюдались в других образцах, покрывали большую часть поверхности электрода. Однако, в отличие от других образцов, нанопроволоки или наностержни ZnO или каких-либо признаков дендритного роста цинка не наблюдались.
После третьего разряда очень большие кристаллы ZnO, которые также наблюдались в других образцах, покрывали большую часть поверхности электрода. Однако, в отличие от других образцов, нанопроволоки или наностержни ZnO или каких-либо признаков дендритного роста цинка не наблюдались. Батареи с цинковыми электродами, приготовленными из коммерческого порошка ZnO (образец C1), показывают более медленное падение напряжения от начальной точки до примерно 1,35 В (плато разряда) перед резким падением напряжения, приводящим к более высокой разрядной емкости, 2,06 Ач, по сравнению с другими образцами с синтезированные порошки ZnO. В батареях NiZn с синтезированными порошками ZnO емкость образцов A1 и B1 была на 21% и 8% ниже соответственно. Все батареи показали одинаковую разрядку; однако среди множества подготовленных образцов батареи NiZn с коммерческими порошками ZnO неизменно показали более высокую разрядную емкость.При номинальном разрядном напряжении 1,6 В батареи NiZn с синтезированными порошками ZnO показали среднюю плотность энергии в диапазоне от 92 Втч кг -1 до 109 Втч кг -1 . Аккумуляторы NiZn с коммерческими порошками ZnO показали самую высокую удельную энергию, 118 Вт · ч · кг -1 .
Батареи с цинковыми электродами, приготовленными из коммерческого порошка ZnO (образец C1), показывают более медленное падение напряжения от начальной точки до примерно 1,35 В (плато разряда) перед резким падением напряжения, приводящим к более высокой разрядной емкости, 2,06 Ач, по сравнению с другими образцами с синтезированные порошки ZnO. В батареях NiZn с синтезированными порошками ZnO емкость образцов A1 и B1 была на 21% и 8% ниже соответственно. Все батареи показали одинаковую разрядку; однако среди множества подготовленных образцов батареи NiZn с коммерческими порошками ZnO неизменно показали более высокую разрядную емкость.При номинальном разрядном напряжении 1,6 В батареи NiZn с синтезированными порошками ZnO показали среднюю плотность энергии в диапазоне от 92 Втч кг -1 до 109 Втч кг -1 . Аккумуляторы NiZn с коммерческими порошками ZnO показали самую высокую удельную энергию, 118 Вт · ч · кг -1 . Сообщалось, что с помощью порошков наночастиц ZnO с тщательно контролируемой морфологией в Zn-электродах можно получить высокую среднюю разрядную емкость для цинковых электродов.Например, электрохимическая активность нанопроволок ZnO со средней разрядной емкостью 609 мАч g -1 оказалась выше, чем у обычного ZnO [32]. В аналогичном исследовании начальная разрядная емкость полого веретенообразного ZnO и гексагонального конусообразного ZnO составила 476 мАч г -1 и 470 мАч г -1 , соответственно [33]. Однако о влиянии разрядной емкости цинкового электрода на плотность энергии батареи не сообщалось. Хотя значения плотности энергии призматических NiZn аккумуляторов, подготовленных в этом исследовании, намного выше, чем средние плотности энергии коммерчески доступных сегодня NiZn аккумуляторов, средняя разрядная емкость цинковых электродов варьируется от 270 до 345 мА г -1 , что намного ниже заявленных значений для нано порошки ZnO в литературе.
Сообщалось, что с помощью порошков наночастиц ZnO с тщательно контролируемой морфологией в Zn-электродах можно получить высокую среднюю разрядную емкость для цинковых электродов.Например, электрохимическая активность нанопроволок ZnO со средней разрядной емкостью 609 мАч g -1 оказалась выше, чем у обычного ZnO [32]. В аналогичном исследовании начальная разрядная емкость полого веретенообразного ZnO и гексагонального конусообразного ZnO составила 476 мАч г -1 и 470 мАч г -1 , соответственно [33]. Однако о влиянии разрядной емкости цинкового электрода на плотность энергии батареи не сообщалось. Хотя значения плотности энергии призматических NiZn аккумуляторов, подготовленных в этом исследовании, намного выше, чем средние плотности энергии коммерчески доступных сегодня NiZn аккумуляторов, средняя разрядная емкость цинковых электродов варьируется от 270 до 345 мА г -1 , что намного ниже заявленных значений для нано порошки ZnO в литературе. Кроме того, коммерческий порошок ZnO с наименьшей площадью поверхности (образец С1) показал лучшую разрядную способность и привел к более высокой плотности энергии. Очевидно, что более высокая площадь поверхности электрода или более высокая разрядная емкость электрода не обязательно означает более высокую плотность энергии для NiZn-аккумуляторов. Чтобы улучшить разрядную емкость электрода, необходимо синтезировать порошки нано ZnO с тщательно контролируемой морфологией, что обычно увеличивает стоимость производства. Другой подход к увеличению разрядной емкости электрода заключается в использовании гораздо более тонких электродов, но этот подход увеличивает вес батареи из-за большего токосъемника и сепаратора, что приводит к более низкой плотности энергии батареи.В отличие от предыдущих исследований, использование обычного порошка ZnO для цинковых электродов привело к лучшей циклической стабильности. Как видно на рисунке 8, цинковые электроды с промышленным порошком ZnO показали менее 3% потери емкости после 50 циклов по сравнению с 35% для образца A1 и 8% для образца B1, соответственно.
Кроме того, коммерческий порошок ZnO с наименьшей площадью поверхности (образец С1) показал лучшую разрядную способность и привел к более высокой плотности энергии. Очевидно, что более высокая площадь поверхности электрода или более высокая разрядная емкость электрода не обязательно означает более высокую плотность энергии для NiZn-аккумуляторов. Чтобы улучшить разрядную емкость электрода, необходимо синтезировать порошки нано ZnO с тщательно контролируемой морфологией, что обычно увеличивает стоимость производства. Другой подход к увеличению разрядной емкости электрода заключается в использовании гораздо более тонких электродов, но этот подход увеличивает вес батареи из-за большего токосъемника и сепаратора, что приводит к более низкой плотности энергии батареи.В отличие от предыдущих исследований, использование обычного порошка ZnO для цинковых электродов привело к лучшей циклической стабильности. Как видно на рисунке 8, цинковые электроды с промышленным порошком ZnO показали менее 3% потери емкости после 50 циклов по сравнению с 35% для образца A1 и 8% для образца B1, соответственно.
 Вопреки выводам этого исследования, NiZn батареи, изготовленные из нанопроволоки и наноразмерного ZnO, как сообщалось, демонстрируют лучшую разрядную емкость и стабильность цикла, более высокое напряжение разряда и более низкое напряжение заряда. Лучшие электрохимические характеристики были объяснены эффектами подложки, электрохимической активностью частиц ZnO, толщиной электроосаждений и плотностью тока заряда / разряда, которые обычно благоприятствуют частицам нано ZnO в большинстве NiZn батарей [8].
Вопреки выводам этого исследования, NiZn батареи, изготовленные из нанопроволоки и наноразмерного ZnO, как сообщалось, демонстрируют лучшую разрядную емкость и стабильность цикла, более высокое напряжение разряда и более низкое напряжение заряда. Лучшие электрохимические характеристики были объяснены эффектами подложки, электрохимической активностью частиц ZnO, толщиной электроосаждений и плотностью тока заряда / разряда, которые обычно благоприятствуют частицам нано ZnO в большинстве NiZn батарей [8]. Более низкие характеристики электродов с наноразмерным порошком ZnO по сравнению с электродами с промышленным порошком ZnO должны быть связаны с изменением морфологии цинкового электрода, так как все остальные параметры в этом исследовании остаются неизменными.
Более низкие характеристики электродов с наноразмерным порошком ZnO по сравнению с электродами с промышленным порошком ZnO должны быть связаны с изменением морфологии цинкового электрода, так как все остальные параметры в этом исследовании остаются неизменными. Мы подозреваем, что исходный состав электродов и условия заряда / разряда, использованные в этом исследовании, приводят к изменению морфологии, при котором перенос массы цинката ограничивается диффузией, что приводит к росту дендритов при зарядке и, следовательно, к потере емкости для Образца A1 и Образца B1, батарей с цинком. электроды, изготовленные из порошков нано ZnO.
Мы подозреваем, что исходный состав электродов и условия заряда / разряда, использованные в этом исследовании, приводят к изменению морфологии, при котором перенос массы цинката ограничивается диффузией, что приводит к росту дендритов при зарядке и, следовательно, к потере емкости для Образца A1 и Образца B1, батарей с цинком. электроды, изготовленные из порошков нано ZnO. Также в электролите KOH не было добавок, упрощающих химию. Возможно, что отсутствие добавок, которые, как было доказано, улучшают разрядную емкость цинкового электрода, является причиной более низкой разрядной емкости, указанной здесь.
Также в электролите KOH не было добавок, упрощающих химию. Возможно, что отсутствие добавок, которые, как было доказано, улучшают разрядную емкость цинкового электрода, является причиной более низкой разрядной емкости, указанной здесь.