Утилизация отходов органических растворителей, красок, лаков, клея, мастик и смол
ГлавнаяОтходыУтилизация отходов органических растворителей, красок, лаков, клея, мастик и смолБольшая часть всего созданного человеком является опасным не только для природы, но и для него самого. Взять к примеру такие вещества, как растворители, краски, смолы, лаки, клей… В сфере строительства и ремонта без них просто невозможно обойтись. Однако если вовремя не подвергать их утилизации, отходы органических растворителей, красок, лаков, клея, мастик и смол могут нанести немалый вред экологии и здоровью людей.
Чаще всего утилизация отходов органических растворителей, красок, лаков, клея, мастик и смол производится методом сжигания в специальных печах. Однако не все из вышеперечисленных материалов могут быть бесследно уничтожены при помощи этого метода. Процесс утилизации указанных отходов должен проводиться по другой технологии.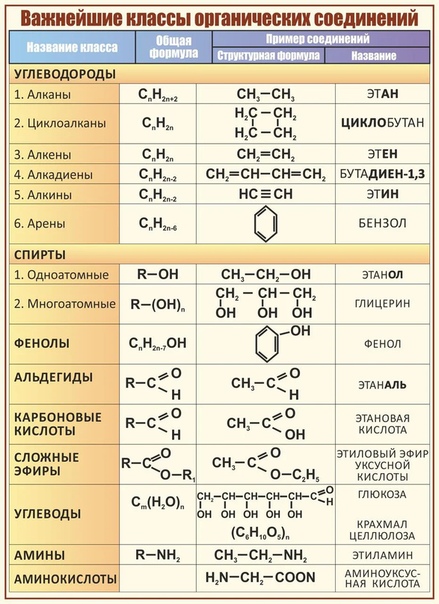
- Исследование отходов и выбор необходимой предварительной подготовки. На этом же этапе производится поглощение жидких компонентов и нейтрализация отвердителей с сильнокислотной или сильнощелочной реакцией. Затем отходы вместе с тарой измельчают в дробилке и помещают в герметичные контейнеры.
- Cмешение отходов в заданном соотношении. В результате получаются добавки для производства цемента. Отходы не только не приносят вред, но и приносят пользу. Таким образом, эта технология утилизации является полностью безотходной.
Компания «ЭкоЛогика» использует для
«ЭкоЛогика» предоставляет следующие услуги:
Уничтожение отходов органических галогеносодержащих растворителей, их смесей и других галогенированных жидкостей
Растворители – химические соединения и их смеси, способные растворять различные вещества. Эти вещества очень токсичны, физиологически активны, многие из них пожаро- и взрывоопасны. Поэтому утилизация отходов органических галогеносодержащих растворителей
Эти вещества очень токсичны, физиологически активны, многие из них пожаро- и взрывоопасны. Поэтому утилизация отходов органических галогеносодержащих растворителей
Утилизация отходов негалогенированных органических растворителей и их смесей
Негалогенированные органические растворители имеют очень широкий спектр сфер применения:
- производство пластмасс, лаков, красок, смол, клеев
- полиграфия
- резиновая промышленность
- химическая чистка одежды
Эта группа отходов также является токсичной и вредной для природы и здоровья человека. Поэтому уничтожение отходов негалогенированных органических растворителей и их смесей

Утилизация отходов ацетона
Ацетон представляет собой бесцветную летучую жидкость с характерным запахом. Ежегодно в мире производится более 3-х млн. тонн ацетона. Вот почему утилизация отходов ацетона является очень важной для сохранения экологии.
Из-за высокой летучести значительная часть ацетона испаряется в атмосферу. Это токсичное вещество, которое обладает возбуждающим и наркотическим действием, поражает центральную нервную систему. Поэтому на предприятиях своевременно должно проводиться
Утилизация отходов этилацетата
Этилацетат – это бесцветная подвижная жидкость с приятным сладковатым запахом. Этилацетат является одним из самых популярных ядов для умерщвления насекомых, вместе с тем он зарегистрирован в качестве пищевой добавки.
Утилизация отходов этилацетата должна производиться с большой осторожностью. Несмотря на низкую токсичность, длительное вдыхание его паров раздражает слизистые оболочки глаз и дыхательных путей, вызывает дерматиты.
Утилизация отходов этиленгликоля
Этиленгликоль бесцветен и не имеет запаха. Отличить его можно по маслянистой консистенции и сладковатому вкусу. Легко воспламеняется, токсичен. Попадание его в организм человека может привести к летальному исходу. Утилизация отходов этиленгликоля очень важна для сохранения окружающей среды.
В связи с широким применением на производстве большое количество уже непригодного вещества застаивается на складах. Поэтому нужно своевременно проводить
Утилизация отходов бензола
Бензол входит в десятку важнейших веществ химической промышленности. Вместе с тем, длительное воздействие этого вещество на организм человека способно привести к самым неблагоприятным последствиям. Правильное произведениеутилизации отходов бензола способно их предотвратить. Остатки бензола, потерявшего потребительские свойства лучше уничтожить с помощью специальной техники.
Правильное произведениеутилизации отходов бензола способно их предотвратить. Остатки бензола, потерявшего потребительские свойства лучше уничтожить с помощью специальной техники.
Утилизация отходов эфира диэтилового
Диэтиловый эфир необходим в медицине, применяется в качестве наркоза. Остатки эфира диэтилового, потерявшего потребительские свойства часто хранятся в больницах и госпиталях. Это недопустимо, так как
Уничтожение отходов пиридина
Пиридин – бесцветная жидкость с резким неприятным запахом. Несвоевременное проведение утилизации отходов пиридина на предприятиях может привести к болезням сотрудни
Окислительно-восстановительные реакции с участием органических веществ » HimEge.ru
В окислительно-восстановительных реакциях органические вещества чаще проявляют свойства восстановителей, а сами окисляются.
Склонность органических соединений к окислению возрастает с ростом их нуклеофильности, что соответствует следующим рядам:
Рост нуклеофильности в ряду
Рассмотрим окислительно-восстановительные реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
Окисление алкенов
При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
3C2H4 + 2KMnO4 + 4H2O → 3CH2OH–CH2OH + 2MnO2 + 2KOH
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH3CH=CHCH2
2) 5CH3CH=CH2 + 10KMnO4 + 15H2SO4 → 5CH3COOH + 5CO2 + 10MnSO4 + 5K2SO4 + 20H2O
3) CH3CH=CHCH2CH3 + 8KMnO4 + 10KOH → CH3COOK + C2H5COOK + 6H2O + 8K2MnO4
4) CH3CH=CH2 + 10KMnO4 + 13KOH → CH3COOK + K2CO3 + 8H2O + 10K
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
При окислении алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, происходит образование двух кетонов:
Окисление алкинов
Алкины окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алкенов, атомы-восстановители здесь – атомы углерода, связанные кратной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH3C≡CH + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5CO2 + 8MnSO4 + 4K2SO4 + 12H2O
Ацетилен может быть окислен перманганатом калия в нейтральной среде до оксалата калия:
3CH≡CH +8KMnO4→ 3KOOC –COOK +8MnO2 +2КОН +2Н2О
В кислотной среде окисление идет до щавелевой кислоты или углекислого газа:
5CH≡CH +8KMnO4 +12H2SO4 → 5HOOC –COOH +8MnSO4 +4К2SO4 +12Н2О
CH≡CH + 2KMnO4 +3H2SO4 → 2CO2 + 2MnSO4 + 4H2O + K2SO4
Окисление гомологов бензола
Бензол не окисляется даже в довольно жестких условиях. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C6H5CH3 +2KMnO4 → C6H5COOK + 2MnO2 + KOH + H2O
C6H5CH2CH3 + 4KMnO4 → C6H5COOK + K2CO3 + 2H2O + 4MnO2 + KOH
Окисление гомологов бензола дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
5С6Н5СН3+6КMnO4+9 H2SO4→ 5С6Н5СООН+6MnSO4 +3K2SO4 + 14H2O
5C6H5–C2H5 + 12KMnO4 + 18H2SO4 → 5C6H5COOH + 5CO2 + 12MnSO4 + 6K2SO4 + 28H2O
Окисление спиртов
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O
С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
5C2H5OH + 4KMnO4 + 6H2SO4 → 5CH3COOH + 4MnSO4 + 2K2SO4 + 11H2O
3CH3–CH2OH + 2K2Cr2O7 + 8H2SO4 → 3CH3–COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа.
Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислой среде с раствором KMnO4 или K2Cr2O7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.
5СН2(ОН) – СН2(ОН) + 8КMnO4+12H2SO4→ 5HOOC –COOH +8MnSO4 +4К2SO4 +22Н2О
3СН2(ОН) – СН2(ОН) + 8КMnO4→ 3KOOC –COOK +8MnO2 +2КОН +8Н2О
Окисление альдегидов и кетонов
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K2Cr2O7, [Ag(NH3)2]OH, Cu(OH)2. Все реакции идут при нагревании:
3CH3CHO + 2KMnO4 → CH3COOH +
Органические вещества Википедия
Метан, CH4; одно из простейших органических веществОргани́ческие соединения, органические вещества́ — вещества, относящиеся к углеводородам или их производным, то есть это класс химических соединений, объединяющий почти все химические соединения, в состав которых входит углерод[1] (за исключением карбидов, угольной кислоты, карбонатов, некоторых оксидов углерода, роданидов, цианидов).
Органические соединения редки в земной коре, но обладают большой важностью, потому что все известные формы жизни основаны на органических соединениях. Такие вещества часто включены в дальнейший круговорот жизни, как например органические вещества почвы (к слову, годовая продукция углеводородов биосферы составляет 380 млрд.т)[2]. Основные дистилляты нефти считаются строительными блоками органических соединений[3]. Органические соединения, кроме углерода (C), чаще всего содержат водород (H), кислород (O), азот (N), значительно реже — серу (S), фосфор (P), галогены (F, Cl, Br, I), бор (B) и некоторые металлы (порознь или в различных комбинациях)<ref>Хомченко Г. П. Пособие по химии для поступающих в вузы. — 4-е изд. испр. и доп. — М.: ООО «Издательство Нов
История
Название органические вещества появилось на ранней стадии развития химии во времена господства виталистических воззрений, продолжавших традицию Аристотеля и Плиния Старшего о разделении мира на живое и неживое. В 1807 году шведский химик Якоб Берцелиус предложил назвать вещества, получаемые из организмов, органическими, а науку, изучающую их, — органической химией. Считалось, что для синтеза органических веществ необходима особая «жизненная сила» (лат. vis vitalis), присущая только живому, и поэтому синтез органических веществ из неорганических невозможен. Это представление было опровергнуто Фридрихом Вёлером, учеником Берцелиуса, в 1829 году путём синтеза «органической» мочевины из «минерального» цианата аммония, однако деление веществ на органические и неорганические сохранилось в химической терминологии и по сей день.
В 1807 году шведский химик Якоб Берцелиус предложил назвать вещества, получаемые из организмов, органическими, а науку, изучающую их, — органической химией. Считалось, что для синтеза органических веществ необходима особая «жизненная сила» (лат. vis vitalis), присущая только живому, и поэтому синтез органических веществ из неорганических невозможен. Это представление было опровергнуто Фридрихом Вёлером, учеником Берцелиуса, в 1829 году путём синтеза «органической» мочевины из «минерального» цианата аммония, однако деление веществ на органические и неорганические сохранилось в химической терминологии и по сей день.
Количество известных органических соединений составляет почти 27 млн.
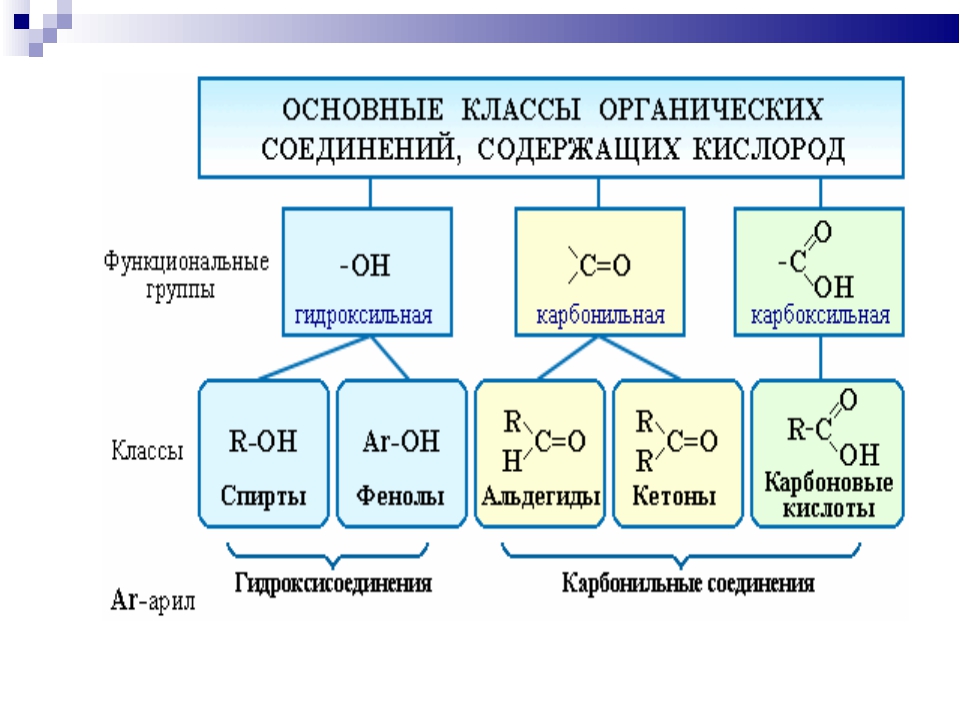
Таким образом, органические соединения — самый обширный класс химических соединений. Многообразие органических соединений связано с уникальным свойством углерода образовывать цепочки из атомов, что в свою очередь обусловлено высокой стабильностью (то есть энергией) углерод-углеродной связи. Связь углерод-углерод может быть как одинарной, так и кратной — двойной, тройной.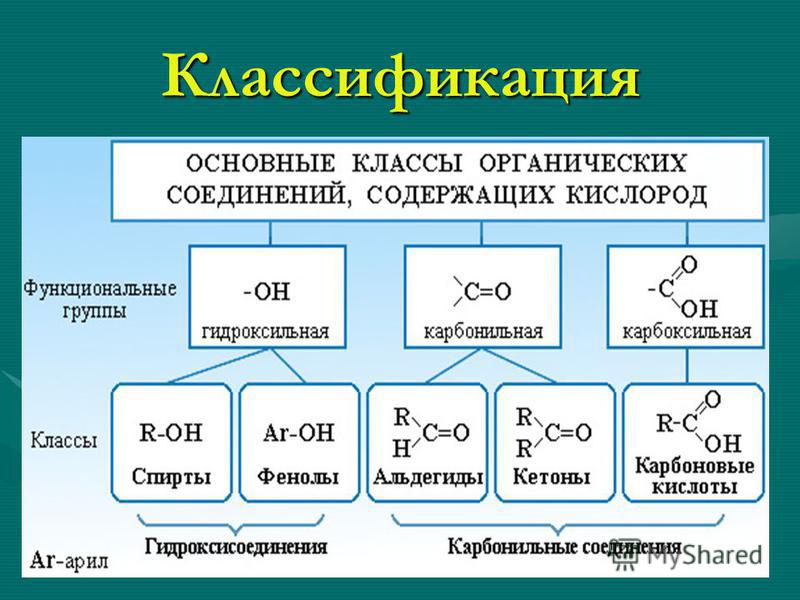 При увеличении кратности углерод-углеродной связи возрастает её энергия, то есть стабильность, а длина уменьшается. Высокая валентность углерода — 4, а также возможность образовывать кратные связи, позволяет образовывать структуры различной размерности (линейные, плоские, объёмные).
При увеличении кратности углерод-углеродной связи возрастает её энергия, то есть стабильность, а длина уменьшается. Высокая валентность углерода — 4, а также возможность образовывать кратные связи, позволяет образовывать структуры различной размерности (линейные, плоские, объёмные).
Классификация
Основные классы органических соединений биологического происхождения — белки, липиды, углеводы, нуклеиновые кислоты — содержат, помимо углерода, преимущественно водород, азот, кислород, серу и фосфор. Именно поэтому «классические» органические соединения содержат прежде всего водород, кислород, азот и серу — несмотря на то, что элементами, составляющими органические соединения, помимо углерода могут быть практически любые элементы.
Соединения углерода с другими элементами составляют особый класс органических соединений — элементоорганические соединения. Металлоорганические соединения содержат связь металл-углерод и составляют обширный подкласс элементоорганических соединений.
Характерные свойства
Существует несколько важных свойств, которые выделяют органические соединения в отдельный, ни на что не похожий класс химических соединений.
- Органические соединения обычно представляют собой газы, жидкости или легкоплавкие твёрдые вещества, в отличие от неорганических соединений, которые в большинстве своём представляют собой твёрдые вещества с высокой температурой плавления.
- Органические соединения большей частью построены ковалентно, а неорганические соединения — ионно.
- Различная топология образования связей между атомами, образующими органические соединения (прежде всего, атомами углерода), приводит к появлению изомеров — соединений, имеющих один и тот же состав и молекулярную массу, но обладающих различными физико-химическими свойствами. Данное явление носит название изомерии.
- Явление гомологии — существование рядов органических соединений, в которых формула любых двух соседей ряда (гомологов) отличается на одну и ту же группу — гомологическую разницу CH2.
 Целый ряд физико-химических свойств в первом приближении изменяется симбатно (мера схожести зависимостей в математическом анализе) по ходу гомологического ряда. Это важное свойство используется в материаловедении при поиске веществ с заранее заданными свойствами.
Целый ряд физико-химических свойств в первом приближении изменяется симбатно (мера схожести зависимостей в математическом анализе) по ходу гомологического ряда. Это важное свойство используется в материаловедении при поиске веществ с заранее заданными свойствами. - Горючесть. [источник не указан 1537 дней]
Номенклатура
Органическая номенклатура — это система классификации и наименований органических веществ. В настоящее время распространена номенклатура ИЮПАК.
Классификация органических соединений построена на важном принципе, согласно которому физические и химические свойства органического соединения в первом приближении определяются двумя основными критериями — строением углеродного скелета соединения и его
Битумоиды и кероген — важнейшие компоненты органического вещества » Строительный ресурс
Ранее мы уже говорили о том, что главным элементом в составе органического вещества, является органический углерод.

Поэтому содержание органического вещества (ОВ) в породах определяется именно по содержанию в них органического углерода (Cорг).
Существуют различные аналитические методы выделения органического вещества из пород и определения его состава. Отличаются они друг от друга в основном применением разных органических растворителей. Мы выбрали аналитическую схему, применяемую во ВНИГРИ — в одном из ведущих институтов в области геохимических исследований (рис. 3.18).
Важнейшими компонентами, извлекаемыми из органического вещества, являются его две составляющие. Это — компоненты, растворимые в органических растворителях — битумоиды и кероген — остаток органического вещества после экстракции из него битумоидов. Кероген не растворяется в органических растворителях, поэтому его достаточно часто называют -«нерастворимое органическое вещество» — НОВ.
В практике геохимических исследований определение группового состава битумоидов является обязательным (рис. 3.19).
Битумоид, экстрагированный хлороформом (CHCl3), называется «хлороформенный битумоид» или ХБ.
 а спиртобензолом — смесью бензола (C6H6) со спиртом (C2H5OH) — «спиртобензольный битумоид» или СПБ.
а спиртобензолом — смесью бензола (C6H6) со спиртом (C2H5OH) — «спиртобензольный битумоид» или СПБ.Битумоиды, так же как и нефти, люминисцируют в длинноволновой части ультрафиолетового света. Это свойство позволяет их изучать не извлекая из породы, с помощью люминесцентной лампы или люминесцентного микроскопа. Установлено, что соотношение битумоидов с вмещающими породами (битуминозные текстуры) бывает различным. Выделяется равномерная битуминозная текстура — в этом случае битумоиды равномерно распределены в породе в виде тонкодисперсной массы. Иногда наблюдается четкая дифференциация битумоидов на тяжелые и легкие компоненты, причем легкие компоненты концентрируются в менее плотных участках породы. При неравномерной текстуре порода селективно насыщена битумоидами. В этом случае битумоиды сконцентрированы в порах и трещинах.
Неравномерные текстуры обычно характерны для миграционного эпигенетичного битумоида.
В составе хлороформенного битумоида содержится углеводородная (масляная) и гетероатомная части органического вещества.
 В составе СПБ битумоида — содержатся более кислые компоненты — смолы и кислоты. Хлороформенный битумоид по элементному составу отличается от нефти. В нем содержится меньше углерода и водорода (С = 73-82 %, H = 8-11 %) и больше гетероэлементов Σ(О + N + S) = 7-20 %. После осаждения асфальтенов, оставшуюся часть битумоидов подвергают разделению с применением стеклянной колонки, внутри которой содержится силикагель. В результате получают различные группы веществ — масла, состоящие в основном из углеводородов, выкипающих выше 200 °C и смолы. Для разделения смол применяют три растворителя: бензол, спиртобензол и петролейный эфир. Соответственно из битумоида выделяют бензольные смолы, спиртобензольные и петролейно-эфирные смолы.
В составе СПБ битумоида — содержатся более кислые компоненты — смолы и кислоты. Хлороформенный битумоид по элементному составу отличается от нефти. В нем содержится меньше углерода и водорода (С = 73-82 %, H = 8-11 %) и больше гетероэлементов Σ(О + N + S) = 7-20 %. После осаждения асфальтенов, оставшуюся часть битумоидов подвергают разделению с применением стеклянной колонки, внутри которой содержится силикагель. В результате получают различные группы веществ — масла, состоящие в основном из углеводородов, выкипающих выше 200 °C и смолы. Для разделения смол применяют три растворителя: бензол, спиртобензол и петролейный эфир. Соответственно из битумоида выделяют бензольные смолы, спиртобензольные и петролейно-эфирные смолы.Смолы представляют собой вещества с молекулярной массой от 500 до 1000, характеризующиеся высокой концентрацией гетероэлементов (высокомолекулярные углеводородные структуры, содержащие в молекуле кроме углерода и водорода серу, азот и кислород). Особенностью гетероэлементов, входящих в состав смол, является повышенное содержание кислорода.

Бензольные смолы более нейтральные, чем остальные. Имеют полужидкую или твердую консистенцию и цвет от оранжевого до темно-коричневого.
Спиртобензольные смолы — темно-коричневые, иногда почти черные. Это твердые, хрупкие вещества, содержащие больше кислорода, чем бензольные смолы.
Асфальтены являются наиболее высокомолекулярной фракцией битумоидов. Они осаждаются петролейном эфиром. Молекулярная масса асфальтенов 1000-8000. Они представляют собой черные вещества, иногда хрупкие. Структура асфальтенов представлена в основном конденсированными ароматическими ядрами. По их периферии располагаются циклические и ациклические заместители, содержащие гетероэлементы.
В практике геохимических исследований значительную роль играют связи битуминозных компонентов с породой. Для их определения применяются различные аналитические методы. Различают так называемый би-тумоид «А» и битумоид «С».
Битумоид «А» извлекают из породы путем холодной и горячей экстракции хлороформом без предварительной обработки соляной кислотой (HCl) (в литературе еще встречается и другое название — ХБА).
Битумоид «С» извлекается после экстракции битумоида «А» путем обработки породы соляной кислотой так как битумоид «С» входит в кристаллическую решетку карбонатных минералов.
В практике геохимических исследований используются ряд коэффициентов, характеризующих органическое вещество пород.
Прежде всего, это степень битуминизации органического вещества (коэффициент β). Он рассчитывается в процентах по формуле β = (ХБА/Cорг)*100 % или β = (ХБ 0,85/Сорг)100 %.
Для определения количества углеводородов в битумоиде и органическом веществе используют соответственно два соотношения: μ1 = (УВ масел/ХБ)-100 % и μ2 = (УВ масел/Сорг)*100 %.
Большое геохимическое значение имеет определение сингенетичности (автохтонности) или эпигенетичности (аллохтонности) битумоидов вмещающим породам.
Сингенетичные битумоиды (СБ) генетически связаны с вмещающими породами и керогеном на месте его образования.
Эпигенетичные битумоиды (ЭБ) — наиболее подвижная, преимущественно углеводородная часть. Она отделилась и переместилась за пределы нефтематеринского пласта в перекрывающие или подстилающие отложения.
Повышенные значения коэффициентов β, μ1 и μ2 по сравнению с фоновыми значениями указывают на эпибитуминозность.
Для определения степени восстановленности органического вещества используется отношение содержания хлороформенного битумоида к спиртобензольному: ХБ/СПБ.
Чем выше этот коэффициент, тем больше восстановлено органическое вещество. Для этих же целей используют и другое соотношение. Это так называемый коэффициент восстановленности: ω = (С + Н/(О + N + S). Чем выше этот коэффициент, тем больше степень восстановленности органического вещества.
Легкая восстановленная часть битумоидов наиболее близка по составу к нефти. Определение генетических типов битумоидов — важный этап в геохимических исследованиях.
Кроме методов экстракции и последующего изучения битумоидов, существуют и другие достаточно информативные методы их исследования, в частности люминисцентно-битуминологические.
Битумоиды обладают способностью люминесцировать, поэтому люминесцентная микроскопия и спектроскопия широко используются для их изучения. Особой информативностью обладает изучение битуминозных веществ под люминископом, так как эти исследования проводятся без дробления породы и, следовательно, без нарушения связи битуминозного вещества с минеральной матрицей.
Прежде всего, изучается характер распределения битуминозных веществ во вмещающей их породе, или так называемые битуминозные текстуры. Эти исследования позволяют достаточно надежно выделить автохтонные, аллохтонные и миграционные битумоиды, а также параавтохтонные битумоиды. (Параавтохтонные битумоиды представляют собой битуминозные компоненты, переместившиеся внутри толщи пород, но не покинувшие этой толщи). Такие битумоиды утратили связь с органическим веществом, в которую они входили составной частью. Для всех этих типов битуминозных веществ характерна определенная текстура. Так, например, равномерная битуминозная текстура характерна для автохтонных битумоидов. Если битумоид сконцентрирован в трещинах и порах (трещинные и поровые текстуры), то это свидетельствует о наличии аллохтонных и миграционных битумоидов.
Селективно-насыщенная текстура (неравномерное распределение битумоидов) — типична для параавтохтонных битумоидов.
Содержание хлороформенных битумоидов в породах является одной из важнейших геохимических характеристик органического вещества. Классификация хлороформенных битумоидов в рассеянном органическом веществе пород приведена в табл. 3.9.
Как видно из таблицы, первые два класса органического вещества содержат мизерное количество битумоида в расчете на породу. Начиная с 3-го класса, в органическом веществе идут интенсивные процессы битумообразования и, следовательно, в нем содержатся повышенные значения наиболее легкой восстановленной части.
До 1967 г. наиболее легкую восстановленную часть битумоидов называли «диффузионно-рассеянная нефть». Это название впервые было предложено И.М. Губкиным.
На основе возможностей современных методов изучать состав OB пород и нефтей на молекулярном уровне Н.Б. Вассоевич предложил называть эту часть битумоидов «микронефть». Термин «микронефть» как нельзя лучше отражает генетическую связь между органическим веществом пород и нефтью. Как образно написал позднее Н.Б. Вассоевич, микронефть — «это эволюционирующая предшественница нефти, ее утробная стадия существования».
На генетическое сходство нефтей и микронефти убедительно указывает сравнительный анализ особенностей распределения индивидуальных углеводородов в нефтях и родственных им микронефтях, который был проведен на основании фактических данных, опубликованных в статье Р. Мартина, Дж. Уинтерса и Дж. Уильямса (рис. 3.20).
Содержание микронефти и ее состав в осадках и породах изменяется по мере развития литогенеза.
В.А. Успенский выявил интересную закономерно
галогенированных органических соединений | CAMEO Chemicals
Лист данных реактивной группы
Что такое реактивные группы?
Реактивные группы — это категории химических веществ, которые обычно реагируют одинаково. способами, потому что они похожи по своей химической структуре. Каждое вещество с химическая таблица была отнесена к одной или нескольким реакционным группам, и CAMEO Chemicals использует назначения реактивных групп для определения своей реакционной способности. предсказания. Подробнее о прогнозах реактивности…
Если вы не можете найти химическое вещество в базе данных, но знаете, какая реактивная группа он принадлежит — вместо этого вы можете добавить реактивную группу в MyChemicals, чтобы чтобы увидеть прогнозы реактивности.
Есть 436 химических паспортов назначен этой реактивной группе.
Описание
Воспламеняемость
Воспламеняемость этих материалов различна. Материалы с низким молекулярным весом (газы и жидкости) обычно опасно воспламеняются.Однако многие галогенированные органические соединения с высокой молекулярной массой, в частности соединения, содержащие несколько атомов галогена на молекулу, негорючие; некоторые фактически используются в качестве антипиренов.
Реакционная способность
Галогенированные алифатические соединения умеренно или очень реакционноспособны. Как правило, они становятся менее реактивными, поскольку большее количество их атомов водорода заменяется атомами галогена. Галогенированные соединения ацетилена нестабильны и должны рассматриваться как взрывчатые вещества. Галогеналканы с низким молекулярным весом легко воспламеняются и могут реагировать с некоторыми металлами с образованием опасных продуктов.Они также подвержены перекисному окислению и могут бурно полимеризоваться. Они могут бурно реагировать с алюминием. Материалы этой группы несовместимы с сильными окислителями и восстановителями. Кроме того, они несовместимы со многими аминами, нитридами, азо / диазосоединениями, щелочными металлами и эпоксидами.
Токсичность
Многие галогенированные углеводороды при вдыхании обладают токсичностью от средней до высокой. Бромированные материалы особенно токсичны. Большая часть токсичности связана с тем, что эти вещества не метаболизируются, а сохраняются и накапливаются в жировых тканях (они обычно жирорастворимы).При сжигании хлорированных органических соединений может образовываться ядовитый газ фосген (COCl2). Другие материалы, образующиеся при неполном сгорании, представляют собой классы хлорированных органических соединений, хлородибензодиоксинов и хлордибензофуранов. Эти соединения вызывают рак при лабораторных исследованиях.
Прочие характеристики
Алкилгалогениды включают углерод, связанный с хлором, бромом и йодидом. Фторуглероды относятся к другой группе. Углерод с двойными связями включен, а ароматические углеводороды относятся к группе 66 (арилгалогениды).Этот класс соединений чрезвычайно важен в промышленности при производстве полимеров, пестицидов и антипиренов.
Примеры
1-хлор-2-бромэтан, бензилбромид, каптан, винилхлорид, винилиденхлорид, метиленхлорид, хлороформ, йодуксусная кислота, иприт, четыреххлористый углерод.
Документация по реактивности
Воспользуйтесь ссылками ниже, чтобы узнать, как эта реактивная группа взаимодействует с любыми реактивных групп в базе данных.
Прогнозируемые опасности и побочные газы для каждой пары реактивных групп будут будет отображаться, а также документация и ссылки, которые использовались для сделать прогнозы реактивности.
Смешайте галогенированные органические соединения с:
- Ацетали, кеталы, полуацетали и полуацетали
- Кислоты карбоновые
- Кислоты сильные неокисляющие
- Кислоты сильные окисления
- Кислоты, слабые
- Акрилаты и акриловые кислоты
- Ацилгалогениды, сульфонилгалогениды и хлорформиаты
- Спирты и полиолы
- Альдегиды
- Алкины с ацетиленовым водородом
- Алкины без ацетиленового водорода
- Амиды и имиды
- Ароматы ароматические
- Амины, фосфины и пиридины
- Ангидриды
- Арилгалогениды
- Азо, диазо, азидо, гидразин и азидные соединения
- Основания, Strong
- Базы, Слабые
- Карбаматы
- Карбонатные соли
- Хлорсиланы
- Конъюгированные диены
- Цианиды, неорганические
- Диазониевые соли
- Эпоксиды
- Сложные эфиры, сульфатные эфиры, фосфатные эфиры, тиофосфатные эфиры и боратные эфиры
- Эфиры
- Фторидные соли растворимые
- Фторированные органические соединения
- Галогенированные органические соединения
- Галогенирующие агенты
- Углеводороды алифатические насыщенные
- Углеводороды алифатические ненасыщенные
- Углеводороды ароматические
- Недостаточно информации для классификации
- Изоцианаты и изотиоцианаты
- Кетоны
- Гидриды металлов, алкилы металлов, арилы металлов и силаны
- Металлы, щелочи, очень активные
- Металлы, элементы и порошок, активный
- Металлы, менее реактивные
- Нитраты и нитритные соединения, неорганические
- Нитриды, фосфиды, карбиды и силициды
- Нитрилы
- Нитро, нитрозо, нитраты и нитритные соединения, органические
- Не окислительно-восстановительные неорганические соединения
- Не реагирует химически
- Металлоорганические
- Окислители сильные
- Окисляющие агенты, слабые
- Оксимы
- Пероксиды органические
- Фенольные соли
- Фенолы и крезолы
- Полимеризуемые соединения
- Четвертичные соли аммония и фосфония
- Восстановители сильные
- Восстанавливающие агенты, слабые
- Соли кислые
- Соль, основная
- Силоксаны
- Сульфиды неорганические
- Сульфиды органические
- Сульфитные и тиосульфатные соли
- Сульфонаты, фосфонаты и тиофосфонаты, органические
- Сложные эфиры и соли тиокарбамата / сложные эфиры и соли дитиокарбамата
- Вода и водные растворы
НЕГАЛОГЕНИРОВАННЫЕ ▷ Русский перевод — Примеры использования негалогенированных веществ в предложении на английском языке
НЕГАЛОГЕНИРОВАННОЕ ПО РУССКОМУ
Результатов: 34, Время: 0.0489
Примеры использования негалогенированный в предложении и их переводы
Organic 101: разрешенные и запрещенные вещества
Автор: Майлз МакЭвой, директор Национальной программы органической продукции в Еда и питание Исследования и наука27 октября 2020 г.
Основное правило органического сельского хозяйства — разрешить использование натуральных веществ и запретить синтетические.Однако для такого домашнего скота, как эти здоровые коровы, вакцины играют важную роль в здоровье животных, особенно потому, что терапия антибиотиками запрещена. (Фото любезно предоставлено Pleasantview Farm, сертифицированной органической молочной фермой в Огайо)Это вторая часть из серии Organic 101, в которой исследуются различные аспекты органических нормативов USDA.
Органические стандарты разработаны, чтобы разрешить использование натуральных веществ в органическом земледелии и запретить использование синтетических веществ. Национальный список разрешенных и запрещенных субстанций — компонент органических стандартов — перечисляет исключения из этого основного правила.
Национальный совет по органическим стандартам (NOSB) создан по закону, чтобы давать рекомендации Национальной органической программе (NOP) о том, какие вещества следует разрешить или запретить. В состав совета входят преданные обществу добровольцы, назначаемые министром сельского хозяйства, и в его состав входят производители экологически чистых продуктов, обработчики, розничные торговцы, экологи, ученые, сертифицированные агенты Министерства сельского хозяйства США и защитники прав потребителей.
Члены NOSB должны использовать определенные критерии при голосовании, включая необходимость в веществе и его влияние на здоровье человека и окружающую среду.В определенных случаях NOSB также голосует за то, чтобы разрешить использование неорганических версий вещества, если оно не доступно в органической форме в масштабах, достаточных для поддержки органического сельского хозяйства.
Некоторые синтетические вещества перечислены как исключения из основного правила и разрешены для использования в органическом сельском хозяйстве. Например, феромоны уже давно используются как эффективный, нетоксичный способ «запутать» насекомых, которые в противном случае могут заразить органические культуры, особенно фрукты. Точно так же вакцины для животных являются важными инструментами профилактики многих инфекционных заболеваний, особенно потому, что антибиотикотерапия запрещена в органическом животноводстве.
Национальный список также разрешает использование некоторых вспомогательных средств обработки, таких как пищевая сода. Это вещество осветляет (или придает форму) тесто для органических блинов, выпечки и других продуктов.
И наоборот, некоторые вещества, такие как стрихнин и мышьяк, являются примерами природных токсичных веществ, запрещенных в органическом производстве.
Процесс добавления или удаления разрешенных веществ — это открытый процесс, позволяющий вносить прямой вклад со стороны органического сообщества. Обычно процесс состоит из следующих шагов:
- Физическое лицо или организация подают официальное ходатайство о добавлении, удалении или изменении списка определенного вещества. Подкомитет
- NOSB рассматривает петицию. Сторонний технический отчет часто используется для сбора научной информации о веществе и выявления любых негативных воздействий на здоровье человека или окружающую среду.
- Подкомитет NOSB публикует предложенную рекомендацию по этому веществу с запросом на публичные комментарии перед публичным собранием, которое обычно проводится дважды в год.
- Во время собрания NOSB обсуждает общественные комментарии, связанные с петицией, а затем голосует на открытом форуме.Все собрания NOSB бесплатны и открыты для публики.
- NOP рассматривает рекомендацию NOSB. NOP может отклонить рекомендацию NOSB о добавлении вещества в Национальный список, но не может добавить вещество, которое не было рекомендовано NOSB.
- Если NOP соглашается с рекомендацией NOSB, он инициирует нормотворчество для внесения поправок в Национальный список для этого вещества.
В ходе этого процесса NOSB посвящает бесчисленное количество часов обсуждению диапазона точек зрения по каждому исследуемому веществу.Процесс общественного обсуждения играет важную роль в обеспечении тщательного рассмотрения всех точек зрения.
Поскольку этот общественный консультативный совет представляет все ключевые секторы органического сообщества, рекомендации NOSB дают NOP бесценную информацию о том, какие вещества следует разрешить или запретить в органическом сельском хозяйстве. NOP приглашает общественность участвовать в этом процессе, поскольку мы формируем будущее органического сельского хозяйства.
Категория / Тема: Еда и питание Исследования и наукаНаписать ответ
Комментарии
Organic 101: можно ли использовать ГМО в органических продуктах?
Автор: Майлз МакЭвой, заместитель администратора Национальной органической программы в Сохранение Еда и питание Технологии21 февраля 2017 г.
Это тринадцатая часть серии Organic 101, в которой исследуются различные аспекты правил USDA для органических продуктов.
Использование генной инженерии или генетически модифицированных организмов (ГМО) запрещено в органических продуктах. Это означает, что органический фермер не может сажать ГМО-семена, органическая корова не может есть ГМО-люцерну или кукурузу, а производитель органических супов не может использовать какие-либо ГМО-ингредиенты. Чтобы соответствовать требованиям Министерства сельского хозяйства США по органическим продуктам, фермеры и переработчики должны продемонстрировать, что они не используют ГМО и что они защищают свою продукцию от контакта с запрещенными веществами, такими как ГМО, от фермы к столу.
Органические предприятия внедряют профилактические методы, основанные на факторах риска для конкретных участков, таких как соседние традиционные фермы или совместное сельскохозяйственное оборудование или перерабатывающие предприятия. Например, некоторые фермеры сажают семена рано или поздно, чтобы избежать одновременного цветения органических и ГМО-культур (что может вызвать перекрестное опыление). Другие собирают урожай до цветения или подписывают соглашения о сотрудничестве с соседними фермами, чтобы избежать посадки ГМО-культур рядом с органическими. Фермеры также определяют края своих земель в качестве буферной зоны, где земля управляется органически, но урожай не продается как органический.Любые общие фермы или технологическое оборудование необходимо тщательно очищать, чтобы предотвратить непреднамеренное воздействие ГМО или запрещенных веществ.
Все эти меры задокументированы в плане органической системы фермера. В этом письменном плане описываются вещества и методы, которые должны использоваться, включая физические барьеры для предотвращения контакта органических культур с запрещенными веществами или продуктами «исключенных методов», такими как ГМО. Проверки на месте и записи подтверждают, что фермеры следуют своему плану органической системы.Кроме того, сертифицирующие агенты проводят тестирование остатков, чтобы определить, подходят ли эти профилактические меры для предотвращения контакта с такими веществами, как запрещенные пестициды, антибиотики и ГМО.
Любая сертифицированная органическая деятельность, в которой обнаружено использование запрещенных веществ или ГМО, может быть подвергнута принудительным мерам, включая потерю сертификации и финансовые санкции. Однако, в отличие от многих пестицидов, в органических правилах Министерства сельского хозяйства США для ГМО нет конкретных уровней толерантности. Таким образом, политика Национальной органической программы гласит, что наличие следов ГМО автоматически не означает, что ферма нарушает правила Министерства сельского хозяйства США.В таких случаях сертифицирующий агент исследует, как произошло непреднамеренное присутствие, и порекомендует, как его можно лучше предотвратить в будущем. Например, они могут потребовать большей буферной зоны или более тщательной очистки общей зерновой мельницы.
USDA поддерживает все методы сельскохозяйственного производства, включая органические, традиционные и биотехнологии. Чтобы помочь этим различным методам лучше сосуществовать, USDA созвало Консультативный комитет по биотехнологии и 21 st Century Agriculture («AC21»).Органические заинтересованные стороны хорошо представлены на AC21. Последние рекомендации Консультативного комитета в настоящее время выполняются (PDF, 62,4 КБ) агентствами USDA.
Потребители покупают органические продукты, ожидая, что они сохранят свою органическую целостность от фермы до рынка, и USDA стремится соответствовать этим ожиданиям. Независимо от того, где он был выращен, если на продукте есть этикетка USDA Organic, он не был произведен с использованием ГМО.
Написать ответ
Комментарии
УК 814.81 Постановление от 18 мая 2005 года о снижении рисков, связанных с использованием определенных особо опасных веществ, препаратов и предметов (Постановление о снижении химической опасности, ORRChem)
При отсутствии иных нормативных положений ответственность за контроль за соблюдением несут кантоны. с положениями настоящего Постановления.
Конфедерация несет ответственность за:
- a. 1
- задачи, поставленные перед ним в статьях 4, 7–12 (свидетельства) и 19;
- б.
- выдача разрешений в соответствии с приложениями;
- г.
- обеспечение соблюдения положений, касающихся импорта и экспорта;
- г.
- исполнение в отношении веществ, препаратов и предметов, служащих интересам национальной обороны.
1 Изменено согласно № I Закона от 7 ноября 2012 г., вступает в силу с 1 декабря 2012 г. (AS 2012 6161).
1 Компетентные федеральные агентства могут делегировать соответствующим государственным органам или частным лицам некоторые или все задачи и полномочия, возложенные на них настоящим Постановлением.
2 Что касается обеспечения охраны здоровья, делегирование полномочий ограничивается статьями 7–12 (сертификаты) и предоставлением информации в соответствии со статьей 28 Закона о химических веществах.
1 В отношении медицинских изделий правоприменение основано на Постановлении о медицинских изделиях от 17 октября 2001 г. 1 .
2 В отношении веществ, препаратов и изделий, относящихся к системам и деятельности, служащим интересам национальной обороны, применяется статья 82 Постановления о химических веществах от 5 июня 2015 г. 2 (ChemO). 3
3 В отношении удобрений также применяются положения о принудительном исполнении Постановления об удобрениях от 10 января 2001 года 4 .
1 По запросу FOPH, FOAG или FOEN таможенные органы должны проверять, соответствуют ли вещества, препараты и изделия положениям настоящего Постановления. 1
2 В случае подозрения на нарушение, они имеют право задерживать товары на границе и вызывать другие правоохранительные органы в соответствии с настоящим Постановлением.Эти органы должны провести дальнейшие расследования и принять необходимые меры.
1 Изменено приложением 4 № 45 к Постановлению о таможне от 1 ноября 2006 г., вступившим в силу с 1 мая 2007 г. (AS 2007 1469).
1 На выборочной основе или по запросу FOPH, FOAG, FOEN или SECO кантональные правоохранительные органы должны проверять вещества, препараты и изделия, размещенные на рынке, в помещениях производителей, торговцев и профессиональных или коммерческие пользователи.Они должны проверять, соответствуют ли вещества, препараты и изделия положениям Приложений, в частности, в отношении состава, маркировки и информации для покупателей. 1
2 Они также должны проверять, соответствует ли использование этих веществ, препаратов и изделий требованиям настоящего Постановления.
3 Если проверенные вещества, препараты или изделия или их использование вызывают жалобу, контролирующий орган должен проинформировать органы, ответственные за постановления в соответствии со статьей 19.Если последние являются кантональными властями, они должны дополнительно проинформировать FOPH, FOEN и SECO, а также, в случае жалоб, касающихся средств защиты растений, FSVO и FOAG, а в случае жалоб, касающихся удобрений, FOAG. 2
1 Изменено No I Закона от 1 июля 2015 г., вступает в силу с 1 сентября 2015 г. (AS 2015 2367).
2 Изменено согласно № I Закона от 1 июля 2015 г., вступает в силу с 1 сентября 2015 г. (AS 2015 2367).
Если инспекция выявляет нарушение положений настоящего Постановления, федеральный орган власти или орган власти кантона, в котором производитель, торговец или пользователь имеет местожительство или зарегистрированный офис, своим постановлением предписывает необходимые меры.
1 Кантоны должны обеспечить предоставление консультаций специалистов по использованию удобрений и средств защиты растений, а также наличие финансовых средств для этих услуг.
2 Им могут потребоваться лица, использующие удобрения или средства защиты растений на профессиональной или коммерческой основе в загрязненных районах:
- a.
- , чтобы воспользоваться советом специалиста, предлагаемым для этой цели;
- б.
- , чтобы предоставить оперативные данные, необходимые для такого совета.
Конфиденциальность данных и обмен данными между правоохранительными органами и другими странами регулируются статьями 73–76 ChemO 2 .
Обязательства по уплате сборов и расчет сборов за административные действия, выполняемые федеральными правоохранительными органами в соответствии с настоящим Постановлением, основаны на Постановлении о сборах за химические вещества от 18 мая 2005 г. 1 .
Органическая химия: алканы и галогенированные углеводороды
Вступительное эссе
Углеводороды — это простейшие органические соединения, но они обладают интересными физиологическими эффектами. Эти эффекты зависят от размера углеводородных молекул и от того, на каком участке тела или в теле они применяются. Алканы с низкой молярной массой — от 1 до примерно 10 или около того атомов углерода — представляют собой газы или легкие жидкости, которые действуют как анестетики. Вдыхание («нюхание») этих углеводородов в бензине или аэрозольных пропеллентах из-за их опьяняющего действия является серьезной проблемой для здоровья, которая может привести к повреждению печени, почек или мозга или к немедленной смерти от удушья из-за отсутствия кислорода.
Проглоченные жидкие алканы в желудке не причиняют большого вреда. Однако в легких они вызывают «химическую» пневмонию, растворяя жироподобные молекулы клеточных мембран в крошечных воздушных мешочках (альвеолах). Легкие не могут выводить жидкость, как при пневмонии, вызванной бактериями или вирусами. Людей, проглотивших бензин или другие смеси жидких алканов, не следует вызывать рвоту, поскольку это увеличивает вероятность попадания алканов в легкие. (Не существует домашнего противоядия от отравления бензином; позвоните в токсикологический центр.)
Жидкие алканы с приблизительно 5–16 атомами углерода на молекулу смывают естественные кожные кожные кожные покровы и вызывают высыхание и растрескивание кожи, в то время как более тяжелые жидкие алканы (содержащие приблизительно 17 или более атомов углерода на молекулу) действуют как смягчающие средства (смягчители кожи). В качестве защитной пленки можно применять такие смеси алканов, как минеральное масло и вазелин. Вода и водные растворы, такие как моча, не растворяют такую пленку, что объясняет, почему вазелин защищает нежную кожу ребенка от опрелостей.
Мы начинаем изучение органической химии с алканов, соединений, содержащих только два элемента, углерод и водород, и имеющих только одинарные связи. Есть несколько других видов углеводородов, различающихся типом связи между атомами углерода и свойствами, возникающими в результате этой связи. В главе 13 «Ненасыщенные и ароматические углеводороды» мы исследуем углеводороды с двойными связями, с тройными связями и с особым видом связи, называемым ароматичностью .Затем в главе 14 «Органические соединения кислорода» мы изучим некоторые соединения, которые считаются производными от углеводородов, путем замены одного или нескольких атомов водорода кислородсодержащей группой. Глава 15 «Органические кислоты и основания и некоторые из их производных» посвящена органическим кислотам и основаниям, после чего мы будем готовы рассмотреть химию самой жизни — биохимию — в оставшихся пяти главах.
12.1 Органическая химия
Цель обучения
- Распознавать состав и свойства, характерные для органических и неорганических соединений.
Ученые 18-го и начала 19-го веков изучали соединения, полученные из растений и животных, и назвали их органическими , поскольку они были изолированы от «организованных» (живых) систем. Соединения, выделенные из неживых систем, таких как горные породы и руды, атмосфера и океаны, были помечены как неорганические . В течение многих лет ученые считали, что органические соединения могут производиться только живыми организмами, поскольку они обладают жизненной силой, присущей только живым системам.Теория жизненной силы начала приходить в упадок в 1828 году, когда немецкий химик Фридрих Велер синтезировал мочевину из неорганических исходных материалов. Он прореагировал цианатом серебра (AgOCN) и хлоридом аммония (NH 4 Cl), ожидая получить цианат аммония (NH 4 OCN). То, что он ожидал, описывается следующим уравнением.
AgOCN + NH 4 Cl → AgCl + NH 4 OCNВместо этого он обнаружил, что продукт представляет собой мочевину (NH 2 CONH 2 ), хорошо известное органическое вещество, легко выделяемое из мочи.Этот результат привел к серии экспериментов, в которых из неорганических исходных материалов были получены самые разные органические соединения. Теория жизненной силы постепенно исчезла, когда химики узнали, что они могут создавать многие органические соединения в лаборатории.
Сегодня органическая химия Изучение химии соединений углерода. это изучение химии соединений углерода и неорганической химии, изучение химии всех других элементов. это изучение химии всех других элементов.Может показаться странным, что мы разделяем химию на две ветви — одну, которая рассматривает соединения только одного элемента, и другую, которая охватывает более 100 оставшихся элементов. Однако такое разделение кажется более разумным, если учесть, что из десятков миллионов охарактеризованных соединений подавляющее большинство составляют соединения углерода.
Примечание
Слово органический имеет разные значения. Органические удобрения, такие как коровий навоз, являются органическими в первоначальном смысле; он получен из живых организмов.Органические продукты — это, как правило, продукты, выращенные без синтетических пестицидов и удобрений. Органическая химия — это химия соединений углерода.
Углерод уникален среди других элементов тем, что его атомы могут образовывать стабильные ковалентные связи друг с другом и с атомами других элементов во множестве вариаций. Полученные молекулы могут содержать от одного до миллионов атомов углерода. В главах 12 «Органическая химия: алканы и галогенированные углеводороды» по 15 «Органические кислоты и основания и некоторые их производные» мы исследуем органическую химию, разделив ее соединения на семейства на основе функциональных групп.(Для получения общей информации об органических функциональных группах см. Главу 4 «Ковалентные связи и простые молекулярные соединения», раздел 4.6 «Введение в органическую химию».) Мы начинаем с простейших членов семейства, а затем переходим к молекулам, которые являются органическими в исходный смысл, то есть они созданы живыми организмами и находятся в них. Эти сложные молекулы (все содержащие углерод) определяют формы и функции живых систем и являются предметом биохимии, темы, представленной в главах 16 «Углеводы» — глава 20 «Энергетический метаболизм».
Органические соединения, как и неорганические соединения, подчиняются всем законам природы. Часто нет четкого различия в химических или физических свойствах органических и неорганических молекул. Тем не менее, полезно сравнить типичные представители каждого класса, как показано в Таблице 12.1 «Общие контрастирующие свойства и примеры органических и неорганических соединений». (Однако имейте в виду, что для каждой категории в этой таблице есть исключения.) Для дальнейшей иллюстрации типичных различий между органическими и неорганическими соединениями, таблица 12.1 «Общие контрастирующие свойства и примеры органических и неорганических соединений» также перечисляют свойства неорганического соединения хлорида натрия (обычная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14 ), используемого растворителя. для извлечения соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию определенных типичных свойств, как показано в Таблице 12.1 «Общие контрастирующие свойства и примеры органических и неорганических соединений».
Таблица 12.1 Общие контрастные свойства и примеры органических и неорганических соединений
| Органическое | Гексан | Неорганическое | NaCl | |
|---|---|---|---|---|
| низкая температура плавления | −95 ° С | высокие температуры плавления | 801 ° С | |
| низкие точки кипения | 69 ° С | высокие точки кипения | 1,413 ° С | |
| низкая растворимость в воде; высокая растворимость в неполярных растворителях | не растворим в воде; растворим в бензине | большая растворимость в воде; низкая растворимость в неполярных растворителях | растворим в воде; не растворим в бензине | |
| легковоспламеняющиеся | легковоспламеняющийся | негорючие | негорючие | |
| водные растворы не проводят электричество | непроводящие | водных растворов проводят электричество | проводящие в водном растворе | |
| демонстрируют ковалентную связь | ковалентных связей | демонстрируют ионную связь | ионных связей |
Упражнения по обзору концепции
Классифицируйте каждое соединение как органическое или неорганическое.
- C 3 H 8 O
- CaCl 2
- Cr (NH 3 ) 3 Класс 3
- C 30 H 48 O 3 N
Какое соединение, вероятно, является органическим, а какое — неорганическим?
- легковоспламеняющееся соединение, кипящее при 80 ° C и не растворимое в воде
- соединение, которое не горит, плавится при 630 ° C и растворимо в воде
ответов
- органический
- неорганическое
- неорганическое
- органический
Ключевые вынос
- Органическая химия — это изучение соединений углерода, почти все из которых также содержат атомы водорода.
Упражнения
Классифицируйте каждое соединение как органическое или неорганическое.
- C 6 H 10
- CoCl 2
- C 12 H 22 O 11
Классифицируйте каждое соединение как органическое или неорганическое.
- СН 3 NH 2
- NaNH 2
- Cu (NH 3 ) 6 Класс 2
Какой член каждой пары имеет более высокую температуру плавления?
- CH 3 OH и NaOH
- CH 3 Cl и KCl
Какой член каждой пары имеет более высокую температуру плавления?
- C 2 H 6 и CoCl 2
- CH 4 и LiH
ответов
- органический
- неорганическое
- органический
12.2 Структуры и названия алканов
Цель обучения
- Определите и назовите простые (линейные) алканы с указанием формул и напишите формулы для алканов с прямой цепью с указанием их названий.
Мы начали наше изучение органической химии в главе 4 «Ковалентные связи и простые молекулярные соединения» с углеводородов. Простейшее органическое соединение, состоящее только из атомов углерода и водорода, простейшее органическое соединение, состоящее только из атомов углерода и водорода.Как мы уже отметили, существует несколько различных видов углеводородов. Их различают типы связи между атомами углерода и свойства, возникающие в результате этой связи. Углеводороды, имеющие только одинарные связи углерод-углерод (C – C) и существующие в виде непрерывной цепочки атомов углерода, также связанных с атомами водорода, называются алканами (или насыщенными углеводородами). Углеводород, имеющий только одинарные связи углерод-углерод и существующий как непрерывная цепочка атомов углерода, также связанных с атомами водорода. Насыщенный , в данном случае, означает, что каждый атом углерода связан с четырьмя другими атомами (водородом или углеродом) — наиболее вероятным; в молекулах нет двойных или тройных связей.
Мы ввели три простейших алкана — метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) — в главе 4 «Ковалентное связывание и простая молекулярная связь. Соединения », раздел 4.6« Введение в органическую химию ». Они снова показаны на рисунке 12.1 «Три простейших алкана». Показанные плоские изображения неточно отображают валентные углы или геометрию молекул. Метан имеет тетраэдрическую форму, которую химики часто изображают с клиньями, указывающими на связи, идущие к вам, и пунктирными линиями, обозначающими связи, отходящие от вас. (Для получения дополнительной информации о форме молекул см. Главу 4 «Ковалентные связи и простые молекулярные соединения», раздел 4.5 «Характеристики молекул».) Обычная сплошная линия обозначает связь в плоскости страницы.
Рисунок 12.1 Три простейших алкана
Вспомните из главы 4 «Ковалентные связи и простые молекулярные соединения», раздела 4.5 «Характеристики молекул», что теория VSEPR правильно предсказывает тетраэдрическую форму молекулы метана (рисунок 12.2 «Тетраэдрическая молекула метана»).
Рисунок 12.2 Тетраэдрическая молекула метана
Метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются началом ряда соединений, в которых любые два члена в последовательности отличаются одним атомом углерода и двумя атомами водорода, а именно единицей CH 2 .Первые 10 членов этой серии приведены в таблице 12.2 «Первые 10 алканов с прямой цепью».
Таблица 12.2 Первые 10 алканов с прямой цепью
| Имя | Молекулярная формула (C n H 2 n + 2 ) | Концентрированная структурная формула | Число возможных изомеров |
|---|---|---|---|
| метан | СН 4 | СН 4 | – |
| этан | С 2 В 6 | СН 3 СН 3 | – |
| пропан | С 3 В 8 | Канал 3 Канал 2 Канал 3 | – |
| бутан | С 4 В 10 | Канал 3 Канал 2 Канал 2 Канал 3 | 2 |
| пентан | С 5 В 12 | Канал 3 Канал 2 Канал 2 Канал 2 Канал 3 | 3 |
| гексан | С 6 В 14 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 | 5 |
| гептан | С 7 В 16 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 | 9 |
| октановое число | С 8 В 18 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 | 18 |
| нонан | С 9 В 20 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 | 35 |
| декан | С 10 В 22 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 | 75 |
Рассмотрим серию на рисунке 12.3 «Члены гомологического ряда». Последовательность начинается с C 3 H 8 , и на каждом шаге вверх по серии добавляется блок CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь группа CH 2 ), называется гомологическим рядом. Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором. такая серия, называемая гомологами , имеет свойства, которые изменяются регулярно и предсказуемо.Принцип гомологии обеспечивает организацию органической химии во многом так же, как периодическая таблица Менделеева обеспечивает организацию неорганической химии. Вместо ошеломляющего множества отдельных углеродных соединений мы можем изучить несколько членов гомологического ряда и из них вывести некоторые свойства других соединений в этом ряду.
Рисунок 12.3 Члены гомологической серии
Каждая последующая формула включает на один атом углерода и на два атома водорода больше, чем предыдущая формула.
Принцип гомологии позволяет записать общую формулу для алканов: C n H 2 n + 2 . Используя эту формулу, мы можем написать молекулярную формулу для любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 H (2 × 8) + 2 = C 8 H 18 .
Упражнения по обзору концепции
В гомологическом ряду алканов, какова молекулярная формула члена, расположенного чуть выше C 8 H 18 ?
Используйте общую формулу алканов, чтобы записать молекулярную формулу алкана с 12 атомами углерода.
Ключевые вынос
- Простые алканы существуют в виде гомологического ряда, в котором соседние члены различаются единицей CH 2 .
Упражнения
Какие соединения содержат меньше атомов углерода, чем C 3 H 8 , и являются ли их гомологами?
Какие соединения содержат от пяти до восьми атомов углерода и являются гомологами C 4 H 10 ?
12.3 алкана с разветвленной цепью
Цель обучения
- Узнайте, как молекулы алканов могут иметь разветвленные цепи, и узнайте соединения, являющиеся изомерами.
Мы можем записать структуру бутана (C 4 H 10 ), разместив четыре атома углерода в ряд,
–C – C – C – C–, а затем добавив достаточно атомов водорода, чтобы каждый атом углерода получил четыре связи:
Составной бутан имеет такую структуру, но есть другой способ соединить вместе 4 атома углерода и 10 атомов водорода.Поместите 3 атома углерода в ряд, а затем ответвите четвертый атом от среднего атома углерода:
Теперь мы добавляем достаточно атомов водорода, чтобы у каждого углерода четыре связи.
Существует углеводород, соответствующий этой структуре, что означает, что два разных соединения имеют одинаковую молекулярную формулу: C 4 H 10 . Два соединения имеют разные свойства — например, одно кипит при -0,5 ° C; другой — при -11,7 ° C. Различные соединения, имеющие одинаковую молекулярную формулу, называются изомерами. Соединения, имеющие одинаковую молекулярную формулу, но разные структурные формулы и свойства.. Соединение с этой разветвленной цепью называется изобутан (Рисунок 12.4 «Бутан и изобутан»).
Рисунок 12.4 Бутан и изобутан
Шариковые модели этих двух соединений показывают, что они являются изомерами; оба имеют молекулярную формулу C 4 H 10 .
Обратите внимание, что C 4 H 10 изображен с изогнутой цепью на Рисунке 12.4 «Бутан и изобутан». Цепь из четырех атомов углерода может быть изогнута по-разному, поскольку группы могут свободно вращаться вокруг связей C – C.Однако это вращение не меняет идентичности соединения. Важно понимать, что изгиб цепи , а не не изменяет идентичность соединения; все следующие элементы представляют собой одно и то же соединение:
Формула изобутана показывает непрерывную цепочку только из трех атомов углерода, с четвертым присоединенным в качестве ответвления от среднего атома углерода непрерывной цепи.
В отличие от C 4 H 10 , соединения метана (CH 4 ), этана (C 2 H 6 ) и пропана (C 3 H 8 ) не существуют в изомерных формы, потому что существует только один способ расположить атомы в каждой формуле так, чтобы каждый атом углерода имел четыре связи.
Следующим за C 4 H 10 в гомологическом ряду является пентан. Каждое соединение имеет одинаковую молекулярную формулу: C 5 H 12 . (В таблице 12.2 «Первые 10 алканов с прямой цепью» есть столбец, в котором указано количество возможных изомеров для первых 10 алканов с прямой цепью.) Соединение в крайнем левом углу является пентаном, потому что оно содержит все пять атомов углерода в непрерывной цепи. . Соединение в середине — изопентан; подобно изобутану, он имеет одно ответвление CH 3 от второго атома углерода непрерывной цепи.Соединение в правом углу, обнаруженное после двух других, было названо неопентаном (от греческого neos , что означает «новый»). Хотя все три имеют одинаковую молекулярную формулу, они имеют разные свойства, в том числе температуры кипения: пентан, 36,1 ° C; изопентан, 27,7 ° С; и неопентан, 9,5 ° С.
Примечание
Непрерывную (неразветвленную) цепочку атомов углерода часто называют прямой цепью , хотя тетраэдрическое расположение каждого углерода придает ей зигзагообразную форму.Алканы с прямой цепью иногда называют нормальными алканами , и их названиям дается префикс n -. Например, бутан называется n -бутан. Мы не будем использовать этот префикс здесь, потому что он не является частью системы, установленной Международным союзом чистой и прикладной химии.
Упражнения по обзору концепции
В алканах может быть двухуглеродная ветвь от второго углеродного атома четырехуглеродной цепи? Объясни.
Студенту предлагается написать структурные формулы для двух различных углеводородов, имеющих молекулярную формулу C 5 H 12 . Она пишет одну формулу со всеми пятью атомами углерода в горизонтальной линии, а другую с четырьмя атомами углерода в линию, с группой CH 3 , идущей вниз от первого, присоединенной к третьему атому углерода. Представляют ли эти структурные формулы разные молекулярные формулы? Объясните, почему да или почему нет.
ответов
Нет; ветвь будет самой длинной непрерывной цепочкой из пяти атомов углерода.
Нет; оба представляют собой непрерывные пятиуглеродные цепи.
Ключевые вынос
- Алканы с четырьмя или более атомами углерода могут существовать в изомерных формах.
Упражнения
Кратко опишите важные различия между алканом с прямой цепью и алканом с разветвленной цепью.
Как связаны бутан и изобутан? Чем они отличаются?
Назовите каждое соединение.
Напишите структурную формулу для каждого соединения.
- гексан
- октановое число
Укажите, представляют ли структуры в каждом наборе одно и то же соединение или изомеры.
Канал 3 Канал 2 Канал 2 Канал 3 и
Канал 3 Канал 2 Канал 2 Канал 2 Канал 3 и
ответов
Алканы с прямой цепью и алканы с разветвленной цепью имеют разные свойства, а также разную структуру.
12.4 Краткие структурные формулы и формулы линейного угла
Цели обучения
- Напишите сжатые структурные формулы для алканов с полными структурными формулами.
- Нарисуйте линейно-угловые формулы по структурным формулам.
Для описания органических соединений мы используем несколько видов формул. Молекулярная формула показывает только виды и количество атомов в молекуле. Например, молекулярная формула C 4 H 10 говорит нам, что в молекуле 4 атома углерода и 10 атомов водорода, но не различает бутан и изобутан. Структурная формула — химическая формула, показывающая, как атомы молекулы связаны друг с другом.показаны все атомы углерода и водорода и их связи. Таким образом, структурные формулы идентифицируют конкретные изомеры, показывая порядок присоединения различных атомов.
К сожалению, структурные формулы сложно напечатать / написать и они занимают много места. Химики часто используют сжатые структурные формулы — органическую химическую формулу, которая показывает атомы водорода (или другие атомы или группы) рядом с атомами углерода, к которым они присоединены. чтобы облегчить эти проблемы.В сжатых формулах атомы водорода показаны рядом с атомами углерода, к которым они присоединены, как показано для бутана:
Конечная сжатая формула — это формула линейного угла — органическая химическая формула, в которой атомы углерода присутствуют в углах и концах линий. Подразумевается, что каждый атом углерода присоединен к достаточному количеству атомов водорода, чтобы дать каждому атому углерода четыре связи, в которых атомы углерода подразумеваются в углах и на концах линий, и каждый атом углерода считается присоединенным к достаточному количеству атомов водорода, чтобы дать у каждого атома углерода четыре связи.Например, мы можем представить пентан (CH 3 CH 2 CH 2 CH 2 CH 3 ) и изопентан [(CH 3 ) 2 CHCH 2 CH 3 ] следующим образом:
Примечание
Скобки в сокращенных структурных формулах указывают на то, что замкнутая группа атомов присоединена к соседнему атому углерода.
Основные выводы
- Краткие химические формулы показывают атомы водорода (или другие атомы или группы) рядом с атомами углерода, к которым они присоединены.
- Формулы линейный угол подразумевают наличие атома углерода в углах и концах линий. Подразумевается, что каждый атом углерода присоединен к достаточному количеству атомов водорода, чтобы дать каждому атому углерода четыре связи.
Упражнения
Напишите сжатую структурную формулу для каждой структурной формулы.
Конденсированная структурная формула для изогексана может быть записана как (CH 3 ) 2 CHCH 2 CH 2 CH 3 .Нарисуйте формулу линейного угла для изогексана.
Нарисуйте формулу линейного угла для соединения CH 3 CH 2 CH (CH 3 ) CH 2 CH 2 CH 3 .
Приведите структурную формулу соединения, представленного этой формулой линейного угла:
ответов
- Канал 3 Канал 3
- СН 3 СН 2 СН 3
- Канал 3 Канал 2 Канал 2 Канал 2 Канал 3
12.5 Номенклатура ИЮПАК
Цель обучения
- Назовите алканы по системе ИЮПАК и напишите формулы для алканов по названиям ИЮПАК.
Как отмечено в таблице 12.2 «Первые 10 алканов с прямой цепью», количество изомеров быстро увеличивается по мере увеличения количества атомов углерода. Есть 3 пентана, 5 гексанов, 9 гептанов и 18 октанов. Было бы трудно присвоить уникальные индивидуальные имена, которые мы могли бы запомнить. Систематический способ обозначения углеводородов и других органических соединений был разработан Международным союзом чистой и прикладной химии (IUPAC).Эти правила, используемые во всем мире, известны как Система номенклатуры ИЮПАК — систематический способ наименования химических веществ таким образом, чтобы каждое из них имело уникальное имя. (Некоторые из названий, которые мы использовали ранее, такие как изобутан, изопентан и неопентан, не соответствуют эти правила и называются общепринятыми именами .) Название стержня (Таблица 12.3 «Стебли, указывающие количество атомов углерода в органических молекулах») указывает количество атомов углерода в самой длинной непрерывной цепи (LCC). Затем называются атомы или группы, присоединенные к этой углеродной цепи, называемые заместителями , а их положения обозначаются числами.Пока мы будем рассматривать только те заместители, которые называются алкильными группами.
Таблица 12.3 Стержни, указывающие количество атомов углерода в органических молекулах
| Шток | Число |
|---|---|
| мет- | 1 |
| eth- | 2 |
| проп- | 3 |
| но- | 4 |
| пент- | 5 |
| шестнадцатеричный — | 6 |
| hept- | 7 |
| окт — | 8 |
| без | 9 |
| дек- | 10 |
Алкильная группа Углеводородная группа, полученная из алкана путем удаления атома водорода.представляет собой группу атомов, которая образуется при удалении одного атома водорода из алкана. Группа названа путем замены суффикса -ane исходного углеводорода на -yl . Например, группа CH 3 , полученная из метана (CH 4 ), получается в результате вычитания одного атома водорода и называется метильной группой .
Алкильные группы, которые мы будем использовать наиболее часто, перечислены в Таблице 12.4 «Общие алкильные группы». Алкильные группы не являются независимыми молекулами; они являются частями молекул, которые мы рассматриваем как единое целое, чтобы систематически называть соединения.
Таблица 12.4 Общие алкильные группы
Упрощенные правила ИЮПАК для наименования алканов следующие (продемонстрированы в примере 12.1).
1. Назовите алканы в соответствии с LCC атомов углерода в молекуле (а не по общему количеству атомов углерода). Этот LCC, считающийся родительской цепью, определяет имя основания, к которому мы добавляем суффикс — ane , чтобы указать, что молекула является алканом.
2. Если углеводород является разветвленным, пронумеруйте атомы углерода LCC. Номера присваиваются в том направлении, которое дает наименьшие числа атомам углерода с присоединенными заместителями. Дефисы используются для отделения чисел от названий заместителей; запятые отделяют числа друг от друга. (LCC не обязательно записывать прямой линией; например, LCC в следующем примере имеет пять атомов углерода.)
3. Поместите названия групп заместителей в алфавитном порядке перед названием родительского соединения. Если одна и та же алкильная группа встречается более одного раза, выражаются номера всех атомов углерода, к которым она присоединена.Если одна и та же группа встречается более одного раза на одном и том же атоме углерода, номер этого атома углерода повторяется столько раз, сколько появляется группа. Причем количество одинаковых групп обозначается греческими префиксами di -, tri -, tetra — и так далее. Эти префиксы , а не , учитываются при определении алфавитного порядка заместителей. Например, этил указан перед диметилом; ди- просто игнорируется. Последняя названная алкильная группа добавляется к названию исходного алкана, образуя одно слово.
При соблюдении этих правил каждое уникальное соединение получает собственное эксклюзивное имя. Правила позволяют нам не только называть соединение по заданной структуре, но и строить структуру по заданному имени. Лучший способ научиться использовать систему IUPAC — это заставить ее работать, а не просто запоминать правила. Это проще, чем кажется.
Пример 1
Назовите каждое соединение.
Решение
- LCC имеет пять атомов углерода, поэтому исходным соединением является пентан (правило 1).К второму атому углерода пентановой цепи присоединена метильная группа (правило 2). Поэтому название — 2-метилпентан.
- LCC имеет шесть атомов углерода, поэтому исходным соединением является гексан (правило 1). Метильные группы (правило 2) присоединены ко второму и пятому атомам углерода. Название — 2,5-диметилгексан.
- LCC имеет восемь атомов углерода, поэтому исходным соединением является октан (правило 1). Есть метильная и этильная группы (правило 2), обе присоединены к четвертому атому углерода (отсчет от справа дает этому атому углерода меньшее число; правило 3).Таким образом, правильное название — 4-этил-4-метилоктан.
Упражнение по развитию навыков
Назовите каждое соединение.
Пример 2
Изобразите структуру каждого соединения.
- 2,3-диметилбутан
- 4-этил-2-метилгептан
Решение
В структурах чертежа всегда начинайте с родительской цепочки.
Исходной цепью является бутан, что указывает на четыре атома углерода в LCC.
Затем добавьте группы на их правильные позиции. Вы можете пронумеровать родительскую цепочку в любом направлении, если будете последовательны; просто не меняйте направления, пока структура не будет готова.Название указывает на две метильные (CH 3 ) группы, одну на втором атоме углерода и одну на третьем.
Наконец, заполните все атомы водорода, помня, что каждый атом углерода должен иметь четыре связи.
Исходной цепью в данном случае является гептан, что указывает на семь атомов углерода в LCC.
–C – C – C – C – C – C – C–Добавление групп в их правильные позиции дает
Заполнение всех атомов водорода дает следующие сжатые структурные формулы:
Обратите внимание, что связи (тире) могут отображаться или нет; иногда они нужны для разнесения.
Упражнение по развитию навыков
Изобразите структуру каждого соединения.
Упражнения по обзору концепции
Как называется группа CH 3 , когда она присоединена к цепочке атомов углерода — заместителю или функциональной группе?
Какой тип имени использует числа для поиска заместителей — общепринятые названия или названия IUPAC?
Ключевые вынос
- Алканы имеют как общие названия, так и систематические названия, определенные IUPAC.
Упражнения
Кратко опишите важные различия между алканом и алкильной группой.
Сколько атомов углерода присутствует в каждой молекуле?
- 2-метилбутан
- 3-этилпентан
Сколько атомов углерода присутствует в каждой молекуле?
- 2,3-диметилбутан
- 3-этил-2-метилгептан
Изобразите структуру каждого соединения.
- 3-метилпентан
- 2,2,5-триметилгексан
- 4-этил-3-метилоктан
Изобразите структуру каждого соединения.
- 2-метилпентан
- 4-этил-2-метилгексан
- 2,2,3,3-тетраметилбутан
Назовите каждое соединение в соответствии с системой IUPAC.
Назовите каждое соединение в соответствии с системой IUPAC.
Что такое заместитель? Как указывается расположение заместителя в системе IUPAC?
Кратко опишите важные различия между общим именем и именем IUPAC.
ответов
Алкан — это молекула; Алкильная группа не является независимой молекулой, а скорее частью молекулы, которую мы рассматриваем как единое целое.
- 2,2,4,4-тетраметилпентан
- 3-этилгексан
Общие названия широко используются, но не очень систематичны; Названия IUPAC идентифицируют исходное соединение и называют другие группы в качестве заместителей.
12.6 Физические свойства алканов
Цель обучения
- Определите физические свойства алканов и опишите тенденции изменения этих свойств.
Поскольку алканы обладают относительно предсказуемыми физическими свойствами и подвергаются относительно небольшому количеству химических реакций, кроме горения, они служат основой для сравнения свойств многих других семейств органических соединений.Давайте сначала рассмотрим их физические свойства.
Таблица 12.5 «Физические свойства некоторых алканов» описывает некоторые свойства некоторых из первых 10 алканов с прямой цепью. Поскольку молекулы алканов неполярны, они нерастворимы в воде, которая является полярным растворителем, но растворимы в неполярных и слабополярных растворителях. (Для получения дополнительной информации о растворимости см. Главу 9 «Растворы», раздел 9.2 «Концентрация».) Следовательно, сами алканы обычно используются в качестве растворителей для органических веществ с низкой полярностью, таких как жиры, масла и воски.Почти все алканы имеют плотность менее 1,0 г / мл и поэтому менее плотны, чем вода (плотность H 2 O составляет 1,00 г / мл при 20 ° C). Эти свойства объясняют, почему масло и жир не смешиваются с водой, а скорее плавают на ее поверхности.
Таблица 12.5 Физические свойства некоторых алканов
| Молекулярное название | Формула | Температура плавления (° C) | Точка кипения (° C) | Плотность (20 ° C) * | Физическое состояние (при 20 ° C) |
|---|---|---|---|---|---|
| метан | СН 4 | –182 | –164 | 0.668 г / л | газ |
| этан | С 2 В 6 | –183 | –89 | 1,265 г / л | газ |
| пропан | С 3 В 8 | –190 | –42 | 1.867 г / л | газ |
| бутан | С 4 В 10 | –138 | –1 | 2,493 г / л | газ |
| пентан | С 5 В 12 | –130 | 36 | 0.626 г / мл | жидкость |
| гексан | С 6 В 14 | –95 | 69 | 0,659 г / мл | жидкость |
| октановое число | С 8 В 18 | –57 | 125 | 0.703 г / мл | жидкость |
| декан | С 10 В 22 | –30 | 174 | 0,730 г мл | жидкость |
| * Обратите внимание на изменение единиц измерения от газов (граммы на литр) к жидкостям (граммы на миллилитр). Плотность газа при давлении 1 атм. | |||||
Рисунок 12.5 Разливы нефти
Сырая нефть покрывает поверхность воды в Мексиканском заливе после того, как нефтяная вышка Deepwater Horizon затонула в результате взрыва. Утечка была на милю ниже поверхности, что затрудняло оценку размера разлива. Один литр масла может создать пятно размером 2,5 гектара (6,3 акра). Эти и подобные разливы напоминают о том, что углеводороды и вода не смешиваются.
Приглядитесь: плотность газа и опасность пожара
Таблица 12.5 «Физические свойства некоторых алканов» указывает на то, что первые четыре члена алканового ряда являются газами при обычных температурах. Природный газ состоит в основном из метана, плотность которого составляет около 0,67 г / л. Плотность воздуха около 1,29 г / л. Поскольку природный газ менее плотен, чем воздух, он поднимается вверх. При обнаружении и отключении утечки природного газа в помещении, газ можно удалить, открыв верхнее окно. С другой стороны, баллонный газ может быть пропаном (плотность 1,88 г / л) или бутаном (смесь бутана и изобутана; плотность около 2.5 г / л). Оба они намного тяжелее воздуха (плотность 1,2 г / л). Если баллонный газ попадает в здание, он собирается у пола. Это представляет собой гораздо более серьезную опасность возгорания, чем утечка природного газа, потому что избавиться от более тяжелого газа из помещения труднее.
Как показано в Таблице 12.5 «Физические свойства некоторых алканов», температуры кипения алканов с прямой цепью увеличиваются с увеличением молярной массы. Это общее правило справедливо для гомологов с прямой цепью всех семейств органических соединений.Более крупные молекулы имеют большую площадь поверхности и, следовательно, сильнее взаимодействуют; поэтому для их разделения требуется больше энергии. Для данной молярной массы точки кипения алканов относительно низкие, потому что эти неполярные молекулы обладают лишь слабыми дисперсионными силами, удерживающими их вместе в жидком состоянии.
Взгляд внимательнее: алкановая основа свойств других соединений
Понимание физических свойств алканов важно в связи с тем, что нефть и природный газ, а также многие производные из них продукты — бензин, газ в баллонах, растворители, пластмассы и др. — состоят в основном из алканов.Это понимание также жизненно важно, поскольку оно является основой для описания свойств других семейств органических и биологических соединений. Например, большая часть структур липидов состоит из неполярных алкильных групп. Липиды включают пищевые жиры и жироподобные соединения, называемые фосфолипидами и сфинголипидами, которые служат структурными компонентами живых тканей. (Для получения дополнительной информации о липидах см. Главу 17 «Липиды».) Эти соединения имеют как полярные, так и неполярные группы, что позволяет им ликвидировать разрыв между водорастворимой и водонерастворимой фазами.Эта характеристика важна для избирательной проницаемости клеточных мембран.
Трипальмитин (а), типичная молекула жира, имеет длинные углеводородные цепи, типичные для большинства липидов. Сравните эти цепи с гексадеканом (b), алканом с 16 атомами углерода.
Упражнения по обзору концепции
Не обращаясь к таблице, сделайте прогноз, у которого температура кипения выше — гексан или октан.Объясни.
Если 25 мл гексана добавить к 100 мл воды в химическом стакане, чего из следующего вы ожидаете? Объясни.
- Гексан растворяется в воде.
- Гексан не растворяется в воде и плавает сверху.
- Гексан не растворяется в воде и опускается на дно емкости.
ответов
- Октан
из-за большей молярной массы
б; гексан не растворим в воде и менее плотен, чем вода.
Ключевые вынос
- Алканы — это неполярные соединения, низкокипящие и нерастворимые в воде.
Упражнения
Не обращаясь к таблице или другой ссылке, спрогнозируйте, какой член каждой пары имеет более высокую точку кипения.
- пентан или бутан
- гептан или нонан
Для какого члена каждой пары гексан является хорошим растворителем?
- пентан или вода
- натрия хлорид или соевое масло
12.7 Химические свойства алканов
Цель обучения
- Определите основные химические свойства алканов.
Молекулы алканов неполярны и поэтому обычно не реагируют с ионными соединениями, такими как большинство лабораторных кислот, оснований, окислителей или восстановителей. Рассмотрим, например, бутан:
Ни положительные, ни отрицательные ионы не притягиваются к неполярной молекуле. Фактически, алканы подвергаются так мало реакциям, что их иногда называют парафинами , от латинского parum affinis , что означает «слабое сродство».”
Алканы подвергаются двум важным реакциям: горению и галогенированию. Ничего не происходит, когда алканы просто смешиваются с кислородом (O 2 ) при комнатной температуре, но когда пламя или искра обеспечивают энергию активации, происходит высоко экзотермическая реакция горения, химическая реакция, в которой вещество соединяется с молекулярным кислородом, образуя кислородсодержащее вещество. соединения других элементов в реакции. протекает энергично. Для метана (CH 4 ) реакция выглядит следующим образом:
CH 4 + 2O 2 → CO 2 + 2H 2 O + теплоЕсли реагенты смешаны надлежащим образом и имеется достаточно кислорода, единственными продуктами являются углекислый газ (CO 2 ), вода (H 2 O) и тепло — тепло для приготовления пищи, обогрева домов и сушки одежды.Однако, поскольку условия редко бывают идеальными, часто образуются другие продукты. При ограничении подачи кислорода побочным продуктом является окись углерода (CO):
2CH 4 + 3O 2 → 2CO + 4H 2 OЭта реакция является причиной десятков смертей каждый год из-за невентилируемых или неправильно настроенных газовых обогревателей. (Аналогичные реакции с аналогичными результатами происходят с керосиновыми обогревателями.)
Алканы также реагируют с галогенами хлором (Cl 2 ) и бромом (Br 2 ) в присутствии ультрафиолетового света или при высоких температурах с образованием хлорированных и бромированных алканов.Например, хлор реагирует с избытком метана (CH 4 ) с образованием хлористого метила (CH 3 Cl).
CH 4 + Cl 2 → CH 3 Cl + HClПри увеличении количества хлора получается смесь продуктов: CH 3 Cl, CH 2 Cl 2 , CHCl 3 и CCl 4 .
Фтор (F 2 ), самый легкий галоген, взрывоопасно соединяется с большинством углеводородов. Йод (I 2 ) относительно инертен.Фторированные и йодированные алканы получают косвенным методом. Мы обсудим названия и использование галогенированных углеводородов в Разделе 12.8 «Галогенированные углеводороды».
Упражнения по обзору концепции
Почему алканы иногда называют парафинами?
Какой галоген наиболее легко реагирует с алканами? Которая реагирует наименее охотно?
ответов
Алканы не вступают в реакцию со многими обычными химическими веществами.Иногда их называют парафинами, от латинского parum affinis , что означает «слабое сродство».
проще всего: F 2 ; наименее охотно: I 2
Ключевые вынос
- Алканы реагируют с кислородом (горение) и галогенами (галогенирование).
Упражнения
Почему алканы обычно не реагируют с ионными соединениями, такими как большинство лабораторных кислот, оснований, окислителей или восстановителей?
Напишите уравнение полного сгорания метана (CH 4 , основной компонент природного газа).
Какая самая важная реакция алканов?
Назовите некоторые вещества, кроме кислорода, которые легко реагируют с алканами.
ответов
Алканы неполярны; они не притягивают ионы.
12.8 Галогенированные углеводороды
Цель обучения
- Назовите галогенированные углеводороды по формулам и напишите формулы для этих соединений по названиям.
Многие органические соединения тесно связаны с алканами.Как мы отмечали в разделе 12.7 «Химические свойства алканов», алканы реагируют с галогенами с образованием галогенированных углеводородов, в простейшем из которых один атом галогена заменен на атом водорода алкана. Еще более тесно связаны циклоалканы, соединения, в которых атомы углерода соединены в кольцо или циклически.
Реакции алканов с галогенами дают галогенированные углеводороды Углеводород, в котором один или несколько атомов водорода заменены атомом галогена., соединения, в которых один или несколько атомов водорода углеводорода заменены атомами галогена:
Замена только одного атома водорода дает алкилгалогенид (или галогеналкан). Соединение, полученное в результате замены атома водорода алкана на атом галогена. общепринятые названия алкилгалогенидов состоят из двух частей: название алкильной группы плюс основа названия галогена с окончанием -ид . В системе IUPAC используется название исходного алкана с префиксом, обозначающим галогеновые заместители, которому предшествует номер, указывающий расположение заместителя.Префиксы: фтор -, хлор -, бром — и йод -. Таким образом, CH 3 CH 2 Cl имеет общее название этилхлорид и название IUPAC — хлорэтан. Алкилгалогениды с простыми алкильными группами (от одного до четырех атомов углерода) часто называют общими названиями. Те, у кого больше атомов углерода, обычно получают имена IUPAC.
Пример 3
Дайте общие названия и названия IUPAC для каждого соединения.
- CH 3 CH 2 CH 2 Br
- (CH 3 ) 2 CHCl
Решение
- Алкильная группа (CH 3 CH 2 CH 2 -) представляет собой пропильную группу, а галоген представляет собой бром (Br). Поэтому обычное название — пропилбромид. В названии IUPAC префикс для брома (bromo) сочетается с названием трехуглеродной цепи (пропан), которому предшествует число, обозначающее атом углерода, к которому присоединен атом Br, поэтому название IUPAC — 1- бромпропан.
- Алкильная группа [(CH 3 ) 2 CH–] имеет три атома углерода, с атомом хлора (Cl), присоединенным к среднему атому углерода. Следовательно, алкильная группа представляет собой изопропил, а обычное название соединения — изопропилхлорид. В названии ИЮПАК атом Cl (префикс , хлор -), присоединенный к среднему (второму) атому углерода пропановой цепи, приводит к 2-хлорпропану.
Упражнение по развитию навыков
Дайте общие названия и названия IUPAC для каждого соединения.
Пример 4
Укажите название IUPAC для каждого соединения.
Решение
- Исходный алкан имеет пять атомов углерода в самой длинной непрерывной цепи; это пентан.Группа брома (Br) присоединена ко второму атому углерода цепи. Название IUPAC — 2-бромпентан.
- Исходный алкан — гексан. Метильная (CH 3) и бром (Br) группы присоединены ко второму и четвертому атомам углерода соответственно. Перечисление заместителей в алфавитном порядке дает название 4-бром-2-метилгексан.
Упражнение по развитию навыков
Укажите название IUPAC для каждого соединения.
Широкий спектр интересных и часто полезных соединений имеет один или несколько атомов галогена на молекулу.Например, метан (CH 4 ) может реагировать с хлором (Cl 2 ), заменяя один, два, три или все четыре атома водорода атомами Cl. Несколько галогенированных продуктов, полученных из метана и этана (CH 3 CH 3 ), перечислены в Таблице 12.6 «Некоторые галогенированные углеводороды» вместе с некоторыми их применениями.
Таблица 12.6 Некоторые галогенированные углеводороды
| Формула | Общее название | Название IUPAC | Некоторые важные применения |
|---|---|---|---|
| Получено из CH 4 | |||
| CH 3 Класс | метилхлорид | хлорметан | хладагент; производство силиконов, метилцеллюлозы и синтетического каучука |
| CH 2 Класс 2 | хлористый метилен | дихлорметан | растворитель лабораторный и промышленный |
| CHCl 3 | хлороформ | трихлорметан | промышленный растворитель |
| CCl 4 | четыреххлористый углерод | тетрахлорметан | растворитель для химической чистки и огнетушители (но более не рекомендуемые к использованию) |
| CBrF 3 | галон-1301 | бромтрифторметан | системы пожаротушения |
| CCl 3 F | хлорфторуглерод-11 (CFC-11) | трихлорфторметан | пенопласт |
| CCl 2 F 2 | хлорфторуглерод-12 (CFC-12) | дихлордифторметан | хладагент |
| Получено из CH 3 CH 3 | |||
| CH 3 CH 2 Класс | этилхлорид | хлорэтан | местный анестетик |
| ClCH 2 CH 2 Класс | этилендихлорид | 1,2-дихлорэтан | растворитель для резины |
| CCl 3 CH 3 | метилхлороформ | 1,1,1-трихлорэтан | растворитель для очистки компьютерных микросхем и форм для формования пластмасс |
Для вашего здоровья: галогенированные углеводороды
Когда-то широко применяемые в потребительских товарах, многие хлорированные углеводороды считаются канцерогенами (веществами, вызывающими рак), а также, как известно, вызывают серьезные повреждения печени.Примером может служить четыреххлористый углерод (CCl 4 ), который когда-то использовался в качестве растворителя для химической чистки и в огнетушителях, но больше не рекомендован для любого использования. Даже в небольших количествах его пары могут вызвать серьезные заболевания при продолжительном воздействии. Более того, он реагирует с водой при высоких температурах с образованием смертоносного фосгена (COCl 2 ), что делает использование CCl 4 в огнетушителях особенно опасным.
Этилхлорид, напротив, используется в качестве наружного местного анестетика.При распылении на коже он быстро испаряется, охлаждая пораженный участок, делая его нечувствительным к боли. Его также можно использовать в качестве экстренной общей анестезии.
Бромсодержащие соединения широко используются в огнетушителях и в качестве антипиренов для одежды и других материалов. Поскольку они тоже токсичны и оказывают неблагоприятное воздействие на окружающую среду, ученые занимаются разработкой более безопасных заменителей для них, как и для многих других галогенированных соединений.
Для вашего здоровья: хлорфторуглероды и озоновый слой
Алканы, замещенные атомами фтора (F) и хлора (Cl), используются в качестве диспергирующих газов в аэрозольных баллончиках, в качестве вспенивающих агентов для пластмасс и в качестве хладагентов.Два наиболее известных из этих хлорфторуглеродов (CFC) перечислены в таблице 12.6 «Некоторые галогенированные углеводороды».
Хлорфторуглероды способствуют парниковому эффекту в нижних слоях атмосферы. Они также диффундируют в стратосферу, где разрушаются ультрафиолетовым (УФ) излучением, высвобождая атомы Cl. Они, в свою очередь, разрушают молекулы озона (O 3 ), которые защищают Землю от вредного УФ-излучения. Действия по всему миру привели к сокращению использования ХФУ и родственных соединений.ХФУ и другие озоноразрушающие соединения, содержащие Cl или бром (Br), заменяются более безвредными веществами. Одной альтернативой являются гидрофторуглероды (ГФУ), такие как CH 2 FCF 3 , которые не содержат Cl или Br для образования радикалов. Другой — гидрохлорфторуглероды (ГХФУ), такие как CHCl 2 CF 3 . Молекулы ГХФУ легче распадаются в тропосфере, и меньше молекул, разрушающих озон, достигает стратосферы.
Озон в верхних слоях атмосферы защищает поверхность Земли от ультрафиолетового излучения солнца, которое может вызывать рак кожи у людей, а также вредно для других животных и некоторых растений.Озоновые «дыры» в верхних слоях атмосферы (серые, розовые и пурпурные области в центре) представляют собой большие области значительного разрушения озона. Они встречаются в основном над Антарктидой с конца августа до начала октября и заполняют их примерно в середине ноября. Истощение озонового слоя отмечено также в арктических регионах. Самая большая озоновая дыра из когда-либо наблюдавшихся произошла 24 сентября 2006 года.
Упражнения по обзору концепции
Как называется ИЮПАК для ГФУ, имеющего формулу CH 2 FCF 3 ? (Подсказка: вы должны использовать число, чтобы указать расположение каждого замещающего атома F.)
Как называется ИЮПАК ГХФУ, имеющий формулу CHCl 2 CF 3 ?
ответов
1,1,1,2-тетрафторэтан
1,1,1-трифтор-2,2-дихлорэтан
Ключевые вынос
- Замена атома водорода в алкане на атом галогена — F, Cl, Br или I — образует галогенированное соединение.
Упражнения
Напишите краткую структурную формулу для каждого соединения.
- метилхлорид
- хлороформ
Напишите краткую структурную формулу для каждого соединения.
- этил бромид
- четыреххлористый углерод
Напишите краткие структурные формулы для двух изомеров, которые имеют молекулярную формулу C 3 H 7 Br.Дайте общее название и название ИЮПАК для каждого.
Напишите сжатые структурные формулы для четырех изомеров, которые имеют молекулярную формулу C 4 H 9 Br. Дайте каждому название ИЮПАК.
Что такое CFC? Как ХФУ участвуют в разрушении озонового слоя?
Объясните, почему каждое соединение менее разрушительно для озонового слоя, чем CFC.
- фторуглероды
- ГХФУ
ответов
CH 3 CH 2 CH 2 Br, пропилбромид, 1-бромпропан; CH 3 CHBrCH 3 , изопропилбромид, 2-бромпропан
соединений, содержащих Cl, F и C; путем высвобождения атомов Cl в стратосферу
12.9 Циклоалканы
Цель обучения
- Назовите циклоалканы по их формулам и напишите формулы для этих соединений по их названиям.
Углеводороды, с которыми мы столкнулись до сих пор, состоят из молекул с открытыми цепями атомов углерода. Когда цепь содержит три или более атомов углерода, атомы могут соединяться с образованием кольца или циклических структур . Самый простой из этих циклических углеводородов — углеводород с кольцом из атомов углерода.имеет формулу C 3 H 6 . К каждому атому углерода присоединены два атома водорода (рис. 12.6 «Пружинная модель циклопропана») и он называется циклопропаном.
Рисунок 12.6 Шариковая модель циклопропана
Пружины изогнуты для соединения атомов углерода.
Для вашего здоровья: Циклопропан как анестетик
Циклопропан с температурой кипения -33 ° C представляет собой газ при комнатной температуре.Это также мощный анестетик быстрого действия с небольшими нежелательными побочными эффектами в организме. Однако он больше не используется в хирургии, так как образует взрывчатые смеси с воздухом почти во всех концентрациях.
Циклоалканы Циклический углеводород только с одинарными связями — циклические углеводороды только с одинарными связями — названы добавлением префикса цикло- к названию соединения с открытой цепью, имеющего такое же количество атомов углерода, как и в кольце. . Таким образом, название циклического соединения C 4 H 8 — циклобутан.Атомы углерода в циклических соединениях могут быть представлены формулами линейный угол , которые приводят к правильным геометрическим фигурам. Однако имейте в виду, что каждый угол геометрической фигуры представляет собой атом углерода плюс столько атомов водорода, сколько необходимо, чтобы дать каждому атому углерода четыре связи.
Некоторые циклические соединения имеют присоединенные группы заместителей. Пример 5 интерпретирует название циклоалкана с одной группой заместителя.
Пример 5
Изобразите структуру каждого соединения.
- циклопентан
- метилциклобутан
Решение
Название циклопентан указывает на циклический (цикло) алкан с пятью (пяти) атомами углерода. Его можно представить в виде пятиугольника.
Название метилциклобутан указывает на циклический алкан с четырьмя (бут-) атомами углерода в циклической части.Его можно представить в виде квадрата с присоединенной группой CH 3 .
Упражнение по развитию навыков
Изобразите структуру каждого соединения.
- циклогептан
- этилциклогексан
Свойства циклических углеводородов в целом очень похожи на свойства соответствующих соединений с открытой цепью.Таким образом, циклоалканы (за исключением циклопропана, который имеет сильно напряженное кольцо) действуют очень похоже на нециклические алканы. Циклические структуры, содержащие пять или шесть атомов углерода, такие как циклопентан и циклогексан, особенно стабильны. В главе 16 «Углеводы» мы увидим, что некоторые углеводы (сахара) в растворе образуют пяти- или шестичленные кольца.
Примечание
Циклопропановое кольцо деформировано, потому что углы C – C – C равны 60 °, а предпочтительный (тетраэдрический) валентный угол равен 109.5 °. (Эта деформация легко проявляется, когда вы пытаетесь построить шарообразную модель циклопропана; см. Рис. 12.6 «Пружинная модель циклопропана».) Циклопентановые и циклогексановые кольца имеют небольшую деформацию, поскольку C – C – C углы близки к предпочтительным углам.
Упражнения по обзору концепции
Какова молекулярная формула циклооктана?
Как называется это соединение по ИЮПАК?
Ключевые вынос
- Многие органические соединения имеют циклическую структуру.
Упражнения
Изобразите структуру каждого соединения.
- этилциклобутан
- пропилциклопропан
Изобразите структуру каждого соединения.
- метилциклогексан
- бутилциклобутан
Циклоалкильные группы могут быть производными циклоалканов таким же образом, как алкильные группы являются производными алканов.Эти группы называются циклопропилом, циклобутилом и так далее. Назовите каждый циклоалкилгалогенид.
Галогенированные циклоалканы могут быть названы системой IUPAC.Как и в случае алкилпроизводных, монозамещенные производные не нуждаются в номере для указания положения галогена. Чтобы назвать дизамещенные производные, атомы углерода нумеруются, начиная с положения одного заместителя (С1) и переходя ко второму замещенному атому кратчайшим путем. Назовите каждое соединение.
ответов
- циклопентилбромид
- циклогексилхлорид
12.10 Конец главы
Краткое содержание главы
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения следующих жирным шрифтом терминов в резюме и спросить себя, как они относятся к темам в главе.
Органическая химия — это химия соединений углерода, а — неорганическая химия, — химия всех других элементов. Атомы углерода могут образовывать стабильные ковалентные связи с другими атомами углерода и с атомами других элементов, и это свойство позволяет образовывать десятки миллионов органических соединений. Углеводороды содержат только атомы водорода и углерода.
Углеводороды, в которых каждый атом углерода связан с четырьмя другими атомами, называются алканами или насыщенными углеводородами . Они имеют общую формулу C n H 2 n + 2 . Любой данный алкан отличается от следующего в ряду единицей CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором, называется гомологической серией .
Атомы углерода в алканах могут образовывать прямые или разветвленные цепи. Два или более соединений, имеющих одинаковую молекулярную формулу, но разные структурные формулы, представляют собой изомеров и друг друга. Для трех самых маленьких алканов не существует изомерных форм; начиная с C 4 H 10 , все другие алканы имеют изомерные формы.
Структурная формула показывает все атомы углерода и водорода и то, как они связаны друг с другом.Сводная структурная формула показывает атомы водорода рядом с атомами углерода, к которым они присоединены. Формула линейного угла — это формула, в которой атомы углерода подразумеваются в углах и на концах линий. Подразумевается, что каждый атом углерода присоединен к достаточному количеству атомов водорода, чтобы дать каждому атому углерода четыре связи.
Система номенклатуры ИЮПАК содержит правила наименования органических соединений. Алкильная группа — это единица, образованная удалением одного атома водорода из алкана.
Физические свойства алканов отражают тот факт, что молекулы алканов неполярны. Алканы нерастворимы в воде и менее плотны, чем вода.
Алканы, как правило, не реагируют с лабораторными кислотами, основаниями, окислителями и восстановителями. Они действительно горят (проходят реакцию горения ).
Алканы реагируют с галогенами, замещая один или несколько атомов галогена на атомы водорода с образованием галогенированных углеводородов .Алкилгалогенид (галогеналкан) представляет собой соединение, полученное в результате замены атома водорода алкана на атом галогена.
Циклоалканы представляют собой углеводороды, молекулы которых представляют собой замкнутые кольца, а не прямые или разветвленные цепи. Циклический углеводород представляет собой углеводород с кольцом из атомов углерода.
Дополнительные упражнения
Вы нашли банку без этикетки, содержащую твердое вещество, плавящееся при 48 ° C.Он легко воспламеняется и легко горит. Вещество не растворяется в воде и плавает на поверхности. Вещество может быть органическим или неорганическим?
Приведите молекулярные формулы метилциклопентана, 2-метилпентана и циклогексана. Какие изомеры?
Что не так с каждым именем? (Подсказка: сначала напишите структуру , как если бы было правильным.) Дайте правильное название для каждого соединения.
- 2-диметилпропан
- 2,3,3-триметилбутан
- 2,4-диэтилпентан
- 3,4-диметил-5-пропилгексан
Что опасно при проглатывании жидкого алкана?
Различают более легкие и тяжелые жидкие алканы с точки зрения их воздействия на кожу.
Ниже приводится формула линии для алкана. Нарисуйте его структуру и дайте название.
Напишите уравнения полного сгорания каждого соединения.
- пропан (баллонное газовое топливо) Октан
- (типичный углеводород в бензине).
Плотность пробы бензина 0,690 г / мл. На основе полного сгорания октана рассчитайте количество в граммах диоксида углерода (CO 2 ) и воды (H 2 O), образовавшихся на галлон (3,78 л) бензина при его использовании в автомобиле.
Изобразите структуры пяти изомерных гексанов (C 6 H 14 ).Назовите каждого по системе ИЮПАК.
Укажите, представляют ли структуры в каждом наборе одно и то же соединение или изомеры.
Рассмотрите приведенные здесь формулы линейного угла и ответьте на вопросы.
- Какая пара формул представляет изомеры? Нарисуйте каждую конструкцию.
- Какая формула представляет собой галогенид алкила? Назовите соединение и напишите его краткую структурную формулу.
- Какая формула представляет собой циклический алкан? Назовите соединение и нарисуйте его структуру.
- Какова молекулярная формула соединения, обозначенного (i)?
ответов
- Два числа необходимы для обозначения двух заместителей; 2,2-диметилпропан.
- Наименьшие возможные числа не использовались; 2,2,3-триметилбутан.
- Этильные заместители невозможны на втором атоме углерода; 3,5-диметилгептан.
- Пропильный заместитель у пятого атома углерода невозможен; 3,4,5-триметилоктан.
Легкие алканы смывают защитные масла кожи; более тяжелые алканы образуют защитный слой.
- C 3 H 8 + 5O 2 → 3CO 2 + 4H 2 O
- 2C 8 H 18 + 25O 2 → 16CO 2 + 18H 2 O
СН 3 СН 2 СН 2 СН 2 СН 2 СН 3 ; гексан
ii и iii; Канал 3 Канал 2 Канал 2 Канал 2 Канал 2 Канал 2 Канал 3 и
- iv; 3-хлорпентан; CH 3 CH 2 CHClCH 2 CH 3
i; этилциклопентан;
- C 7 H 14
 Целый ряд физико-химических свойств в первом приближении изменяется симбатно (мера схожести зависимостей в математическом анализе) по ходу гомологического ряда. Это важное свойство используется в материаловедении при поиске веществ с заранее заданными свойствами.
Целый ряд физико-химических свойств в первом приближении изменяется симбатно (мера схожести зависимостей в математическом анализе) по ходу гомологического ряда. Это важное свойство используется в материаловедении при поиске веществ с заранее заданными свойствами.