Механизм химического никелирования сплавом никель-фосфор
Главная → Механизм химического никелирования

Заказать ХИМИЧЕСКОЕ НИКЕЛИРОВАНИЕ (сплав никель-фосфор) стали
Заказать ХИМИЧЕСКОЕ НИКЕЛИРОВАНИЕ (сплав никель-фосфор) алюминия
1. Общие сведения о химическом никелировании.
Процесс химического никелирования позволяет осаждать покрытия равномерной толщины с отклонениями не более 10% на деталях сложной конфигурации. По сравнению с никелевыми покрытиями, полученными гальваническим способом они обладают более высокой твердостью и износостойкостью, поэтому могут применяться для деталей, работающих в условиях трения, особенно при отсутствии смазки.
Покрытия имеют минимальную пористость и высокие декоративные свойства (особенно при осаждении из свежеприготовленного раствора), поэтому применяются в качестве защитно-декоративных.
Химическое никелирование обязательно выполняется в присутствии одного из сильных восстановителей. Самым распространенным является гипофосфит натрия. В основе процесса лежит реакция взаимодействия гипофосфита натрия с ионами никеля. Гипофосфит натрия гидролизуется в воде с образованием фосфита натрия и атомарного водорода по химической реакции:
NaH2PO2 + Н2О = NaH2PO3 + 2Нат.
Атомарный водород, адсорбированный на поверхности покрываемой детали, восстанавливает ионы никеля по химической реакции:
Ni2+ + 2Нат → Ni + 2Н+
Одновременно атомарный водород взаимодействует с анионами Н2РО2-1 и Н2РО3-1, восстанавливая фосфор до элементарного состояния, который в последствии входит в состав покрытия.
При химическом никелировании всегда выделяется водород:
2Нат → H2
На эту реакцию расходуется более 60 % выделяющегося по реакции водорода.
Реакция восстановления никеля является автокаталитической, т.е. для ее начала необходимо наличие катализатора. Каталитическими свойствами обычно обладает металл детали, например железо, титан, алюминий, а в дальнейшем — никель (отсюда и название механизма — автокаталитический т.е. никель сам провоцирует свой рост на покрываемой детали).
Наносить химический никель можно и на металлы, которые не являются катализаторами данной реакции: медь, серебро и др. В этом случае необходимы предварительный контакт детали с более отрицательным металлом, например с алюминием, или подача короткого импульса тока. На таких металлах, как свинец, кадмий, олово и др., покрытие получить невозможно. Химический никель наносят и на неметаллические материалы: стекло, керамику и пластмассу. Перед нанесением покрытия поверхность подвергают активированию известными методами.
Содержание фосфора в покрытии колеблется в пределах от 3 до 12 % и зависит от кислотности раствора, снижаясь с понижением рН. Возможно, это связано с тем, что скорость восстановления ионов никеля с ростом рН увеличивается быстрее, чем скорость восстановления фосфора.
На скорость химического никелирования оказывают влияние и такие факторы, как температура, концентрация и соотношение гипофосфита натрия и ионов никеля, природа и количество органических добавок.
Температуру рабочего раствора поддерживают равной 80-97 °С. При повышении температуры с 80 до 90 °С скорость осаждения увеличивается в 1,5 раза, а при снижении ее ниже 70 °С процесс осаждения полностью прекращается.
Химическое никелирование протекает при рН 4-4,5 и при рН 8-10, поэтому растворы, в которых происходит осаждение покрытия, делятся на кислые и щелочные. При рН<4 процесс осаждения прекращается. При рН>5,5 начинается гидролиз солей никеля, при этом частицы гидроксида никеля становятся центрами разложения рабочего раствора и может произойти «саморазряд» ванны — выделение металлического никеля во всем объеме раствора.
Так как во время химического никелирования все время выделяется кислота, необходимо вводить различные буферные добавки: уксусную кислоту, янтарную кислоту и т. п. Введение в раствор комплексообразователей препятствует образованию фосфита никеля, который, выпадая в осадок, делает его непригодным для дальнейшего использования.
Обычно раствор используют один раз, при этом 10-15 % исходных компонентов пропадает, а буферные добавки пропадают полностью. Однако из-за своей простоты этот способ широко применяется в промышленности, хотя его и нельзя назвать экологичным.
Кроме буферных добавок и комплексообразователей в растворы вводят в очень малых количествах специальные добавки-стабилизаторы, например катионы сурьмы, висмута и мышьяка.
В кислых растворах оптимальным отношением соли никеля к гипофосфиту натрия, выраженным в молях, является 0,4. Накопление фосфитов никеля оказывает вредное влияние на процесс осаждения: взвешенные частицы труднорастворимых фосфитов оседают на деталях, делая поверхность шероховатой.
Процесс протекает при температуре 80-100 °С. Так как кислотность раствора все время увеличивается из-за образования фосфористой кислоты, добавляют 1-2 %-ный раствор NaOH или 25 %-ный раствор Nh5OH (1:10).
Кислые растворы по сравнению со щелочными имеют ряд преимуществ: они более стабильны, имеют более высокую скорость осаждения и обладают более высокими защитными свойствами.
Щелочные растворы кроме солей никеля и гипофосфита натрия содержат комплексообразователи — аммиак и лимонную кислоту, что позволяет вести процесс осаждения длительное время. Растворимость фосфитов в щелочных растворах значительно выше, чем в кислых. Накапливающийся фосфит не оказывает вредного влияния при концентрации менее 340 г/л. В щелочных растворах можно наносить покрытие на коррозионно-стойкую сталь, алюминий, титан и т. п.
Покрытия, полученные при химическом никелировании, имеют слоистую аморфную структуру. Недостатком покрытия является его хрупкость, которая начинает проявляться при толщине слоя около 10 мкм и выше. После термической обработки покрытие становится кристаллическим и представляет собой твердый раствор никеля с небольшим содержанием фосфора и интерметаллическое соединение Ni3P. Содержание фосфора 4-8 % для щелочных и 8-10 % для кислых растворов.
Термическая обработка позволяет повысить микротвердость покрытий до 8400-11 800 МПа. Термическая обработка стальных деталей производится при температуре 300-400 °С, алюминиевых — при 275-280 °С, а деталей из дюраля — при 375-385 °С. Время выдержки 1 ч. Структурные превращения в покрытиях сопровождаются выделением тепла и изменением объема, поэтому при очень быстром нагреве возможно разрушение покрытий.
Сцепление никель-фосфорных покрытий сильнее сцепления электролитического никеля, так как осаждение происходит равномерно как внутри, так и снаружи детали, заполняя все микроуглубления и неровности. Отклонения толщин не превышают 10%, поэтому химический никель наносят на прецизионные детали, например на плунжерные пары топливных насосов двигателей, мелкие детали в часовой и оптической промышленности и т. п.
Высокие защитные свойства наряду с небольшой пористостью позволяют применять никель-фосфорные покрытия в качестве защитных, в том числе в условиях перегретого пара и воздуха, вплоть до 700 °С. Для увеличения износоустойчивости и снижения коэффициента трения никель-фосфорное покрытие наносят на трущиеся поверхности. Незаменимо покрытие в полевых условиях и в небольших мастерских для восстановления размеров изношенных деталей. Целесообразно нанесение покрытия на крупногабаритные детали.
Скорость осаждения при химическом никелировании колеблется в зависимости от состава электролита от 10 до 25 мкм/ч. Химическое никелирование проводят в проточных и непроточных растворах. В проточных растворах постоянство состава поддерживается при помощи циркуляции раствора по замкнутому циклу: из реактора, в котором происходит осаждение, в теплообменник, где раствор охлаждается до 55 °С, затем насосом перекачивается через фильтр, оттуда самотеком стекает в корректировочный бак и поступает в реактор. Установка снабжена приборами автоматического регулирования рН и температуры.
2. Кинетика процесса химического никелирования.
На рисунке 1 (а и б) приведена диаграмма Е-рН (Е — окислительно-восстановительный потенциал системы). Линии на диаграмме отражают равновесия определенных ОВ реакций в зависимости от рН раствора. На диаграмму нанесены состояния никеля (рисунок 1а), цитратного комплекса никеля (рисунок 1б) и гипофосфита, отвечающие равновесным реакциям, приведенным в таблице 2.
На рисунках 1а и
1б заштрихована область, в которой никель находится в восстановленном
(металлическом) состоянии, в гипофосфит — в окисленном, т. е. область
возможного протекания реакций ХОМ. Сравнение рисунков показывает, что в
присутствии лиганда (цитрат-иона) исчезают оксидные соединения никеля, а
область протекания реакции заметно расширяется как по потенциалам, так и
по интервалам рН.


a б
Рисунок 1 — Диаграмма Е-рН: а — для системы никель — вода, гипофосфит-вода, б - для системы никель — вода, цитратный комплекс никеля — вода, гипофосфит-вода. Номера кривых на диаграмме соответствуют номерам равновесий в табл. 2 состояния никеля (1 — 9) и состояния гипофосфита (10-14).
Таким образом, для организации процесса ХОМ требуется как минимум соль осаждаемого металла, лиганд, восстановитель и щелочь.
В
связи с тем, что величина рН существенно влияет как на термодинамику,
так и на кинетику процесса, в состав раствора ХОМ, как правило, вводится
буферная добавка.
Реакции ХОМ имеют топохимический характер,
т.е. протекают на границе раздела фаз: продукт реакции (металлопокрытие)
— реакционная среда.
Еще одна важная особенность, без которой невозможно длительное протекание реакции ХОМ – автокаталитический характер процесса, т. е. способность осаждаемого металла катализировать процесс восстановления.
Таблица 2 — Уравнения, описывающие равновесия в системах никель — вода и гипофосфит-вода.
|
№ |
Равновесие |
Уравнение, описывающее равновесие |
|
1 |
Ni2++2e + Ni |
E=-0,250+0,0295lg[Ni2+] |
|
2 |
Ni(OH)2+2H++2e =Ni+2H2O |
E=0,110-0,059lgpH |
|
3 |
Ni3O4+2H2O+2H++2e=3Ni(OH)2 |
E=0,897-0,059lgpH |
|
4 |
Ni3O4+H++2e=3Ni2++4H2O |
E=1,977-0,264pH-0,08861lg[Ni2+] |
|
5 |
2Ni2O3+2H++2e=2Ni3O4+H2O |
E=1,305 — 0,059 pH |
|
6 |
2NiO2+2H++2e=Ni2O3+H2O |
E=1,434 — 0,059 pH |
|
7 |
Ni(OH)2+2H+=Ni2++2H2O |
lg[Ni2+] = 12,18 — 2 pH |
|
8 |
NiO2+4H++2e=Ni2++2H2O |
E=1,593-0,118pH-0,0295lg[Ni2+] |
|
9 |
[NiCit]—+2e=Ni+Cit3- |
E=-0,37+0,295lg [NiCit—/Cit3-] |
|
10 |
H2PO3—+2H++2e=H2PO2—+H2O |
E=-0,31 — 0,059 pH |
|
11 |
HPO32-+3H++2e=H2PO3—+H2O |
E=-0,276 — 0,87 pH |
|
12 |
H2PO4—+2H++2e=H2PO3—+H2O |
E=-0,26-0,059pH+0,0295lg [H2PO4—]/[H2PO3—] |
|
13 |
HPO42-+2H++2e=HPO32-+H2O |
E=0,234-0,059pH+0,0295lg [HPO42-]/[HPO32-] |
|
14 |
PO43-+2H2O+2e=HPO32-+3OH— |
E=0,14 — 0,087 pH |
В ходе ХОМ зависимость между массой получаемого металла и временем осаждения имеет сложный вид (рисунок 2). После погружения детали в раствор в течение некоторого времени отсутствуют внешние признаки протекания реакции (участок 1). Видимое протекание реакции ХОМ начинается с некоторого момента Τ0.

Рисунок 2. Зависимость массы осаждаемого металла от времени (пояснения в тексте).
Отрезок времени между 0 и Τ0 носит название индукционного периода. Это время, необходимое для того, чтобы образовались устойчивые малые частицы твердого продукта, обладающие каталитической активностью. После его образования скорость осаждения быстро возрастает (участок II). Торможение процесса (участок III) объясняется выработкой реагентов в ограниченном объёме раствора. Если проводится корректировка раствора, торможения может и не быть.
Процесс ХОМ может быть организован
как однократный или как непрерывный. В первом случае процесс ведется в
ограниченном объеме раствора без корректировки по основным компонентам; в
результате их выработки скорость реакции постепенно падает, раствор
приходит в негодность. В этом случае для характеристики растворов вводят
термин “коэффициент использования”, т. е. отношение того количества
металла, которое реально осадилось из данного раствора, ко всему
количеству металла, содержащемуся в растворе. До недавнего времени
однократная организация процесса использовалась повсеместно. Более
прогрессивным является непрерывный процесс, когда проводится
периодическая или непрерывная корректировка раствора по расходуемым
реагентам. В этом случае срок службы раствора может быть продлен до
нескольких недель, а в идеале — и месяцев. Непременным условием
существования таких растворов является присутствие еще одного класса
компонентов раствора — стабилизаторов.
Стабилизаторы — это вещества, предотвращающие спонтанное протекание реакции в объеме раствора, благодаря чему удлиняется срок службы раствора. Они вводятся в раствор, как правило, в весьма малых концентрациях. Особенностью действия стабилизирующих добавок является то, что они тормозят образование зародышей металлической фазы на начальной стадии их образования, в особенности в объеме раствора. Стабилизаторами могут являться вещества самой разной природы: ПАВ, серо- и селенсодержащие соединения, соли тяжелых металлов, слабые окислители, комплексообразователи и др. Соответственно и механизм их действия может быть различным, например, связывание в комплекс или окисление продуктов, выпадающих в осадок. Чаще всего действие стабилизаторов объясняют их адсорбцией на поверхности частиц в объёме раствора и на покрываемой поверхности. При удачном подборе стабилизаторов они полностью тормозят реакцию в объёме и лишь частично снижают скорость реакции на рабочей поверхности. Наибольшего эффекта добиваются при одновременном использовании нескольких стабилизаторов разного типа.

В настоящее время для описания процесса ХОМ предложены два основных механизма: химический и электрохимический. Первый заключается в химическом взаимодействии восстановителя с восстанавливаемым ионом, при котором происходит непосредственный переход электронов от первого ко второму. Электрохимический механизм предполагает протекание на каталитической поверхности отдельных электрохимических реакций (анодного окисления восстановителя и катодного восстановления ионов металла) путем их сопряжения (рисунок 3)

Рисунок 3. Сопряжение катодного и анодного процессов в ходе ХОМ: 1 – катодное восстановление металла; 2 – анодное окисление восстановителя; Есм – смешанный потенциал (|ik|=|ia|).
Передача электронов осуществляется с обязательным участием поверхности. Движущей силой процесса является анодное окисление восстановителя, создающее отрицательный потенциал для восстановления ионов металла. Скорость всего процесса определяется способностью данного металла катализировать процесс анодного окисления восстановителя.
При сопряжении катодного и анодного процессов в отсутствие внешнего тока в системе устанавливается стационарное состояние, при котором абсолютные значения катодной и анодной плотности тока равны:
|ik | = |ia |,
ik + ia = 0,
а металл приобретает смешанный потенциал Есм. Эта плотность тока и определяет скорость реакции ХОМ. Если скорость процесса, найденная при сопряжении поляризационных кривых, равна реальной скорости металлизации, это служит подтверждением электрохимического механизма процесса. Однако в ряде случаев скорость осаждения металла в модельных системах заметно отличается от реальной, что свидетельствует о частичном или полном протекании процесса ХОМ по иному механизму.
Под химическим никелированием (ХН) понимают процесс никелирования изделий путем восстановления никеля из раствора с помощью содержащегося в растворе восстановителя.
В последнее время процессу ХН приписывают электрохимическую природу. Согласно этому механизму весь процесс восстановления Ni(II) гипофосфитом может быть представлен двумя сопряженными реакциями.
Анодный процесс окисления гипофосфита:
H2PO2— + 2H2O → H2PO3— + Hадс +H3O+ + e. (2)
Катодный процесс восстановления никеля:
Ni + 2e → Ni. (3)
На катоде протекают побочные процессы:
H2PO2— + 2H3O+ + e → P + 4H2O . (4)
2H3O+ + 2e → H2 + 2H2O . (5)
Сопряжение реакций (2) и (3) дает суммарную реакцию окислительно-восстановительного процесса:
zctc.ru
| ПОЛЕЗНЫЕ ССЫЛКИ: БОНУСЫ ИНЖЕНЕРАМ!: МЫ В СОЦ.СЕТЯХ: | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / Водные растворы и смеси для обработки металлов. / / Водные растворы для нанесения и удаления металлических покрытий / / Водные растворы для химического никелирования.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
tehtab.ru
Никелирование в домашних условиях: химическое, гальваническое
Никелирование изделий из металлов позволяет не только защитить их поверхности от коррозии, но и создать на них блестящее покрытие. Такие изделия широко применяются при изготовлении сантехники, автомобильных запчастей, медицинских инструментов и т. д. В связи с этим многие люди задаются вопросом, можно ли выполнить никелирование стали в домашних условиях?
Технология никелирования металлов
Никелирование осуществляется путем нанесения на металлический предмет тонкого слоя никелевого покрытия. Покрыть никелем можно изделия из различных металлов, таких как:
- сталь;
- медь;
- титан;
- алюминий.
Существуют металлы, которые нельзя никелировать:
- олово;
- свинец;
- кадмий;
- сурьма.
Никелевое покрытие обеспечивает защиту изделия от воздействия влаги и различных агрессивных веществ. Часто его наносят в качестве слоя-основы перед хромированием деталей. После нанесения тонкой пленки никеля, напыления из серебра, золота и других металлов держатся более прочно.
В домашних условиях применяются способы, не требующие использования специализированного оборудования. Благодаря этому, никелирование стали, меди, алюминия в бытовых условиях доступно практически каждому человеку. Чтобы получить равномерное покрытие, необходимо предварительно подготовить деталь.
Преимущество никелирования
Как подготовить изделие к никелированию?
Подготовка изделия довольно трудоемкий процесс. Следует полностью исключить наличие коррозии, окислений и т. п. Подготовка проводится в несколько этапов.

Обработка пескоструйным аппаратом
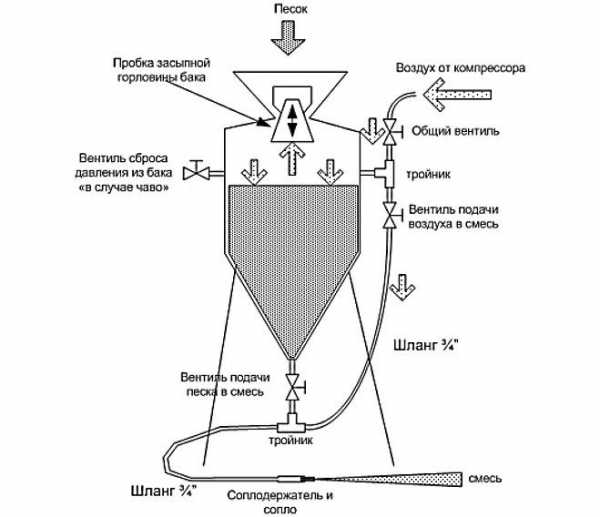
Данный вид обработки можно выполнять как специализированным пескоструйным аппаратом, так и самодельным. Во время обработки нужно постараться убрать как можно больше посторонних наслоений с поверхности заготовки. Особое внимание следует обратить на труднодоступные места. Они должны быть очищены так же, как и другие участки поверхности.

Общая схема пескоструйного аппарата
Шлифовка
Чтобы никелевое покрытие получилось равномерным, нужно максимально выровнять поверхность. Шлифовка дает возможность очистить предмет от оксидной пленки. Для выполнения этого этапа используется наждачная бумага, а также различные инструменты и приспособления, предназначенные для шлифовки.

До и после пескоструйной обработки
Совет: не стоит пренебрегать шлифовкой заготовок, неправильная подготовка может привести к отслоению покрытия.

Следующий этап подготовки металла — шлифовка
Устранение жировых загрязнений
После того, как процесс шлифовки окончен, следует смыть образовавшиеся загрязнения под проточной водой. Затем потребуется провести обезжиривание заготовки. Для этого можно использовать как готовые, так и самодельные растворители. После нанесения растворителя деталь нужно еще раз промыть водой и тщательно просушить.
Внимание: при выборе растворителя необходимо учитывать степень его воздействия на металл, из которого выполнено изделие. Запрещается применять обезжиривающие растворы, вступающие в химическую реакцию с поверхностью.

Обезжиривание металла
Омеднение
Никелирование изделия лучше проводить с предварительным омеднением заготовки. Этот этап не является обязательным, но никелирование стали и других металлов будет более качественным, если покрытие наносится на тонкий слой меди.

Омеднение в домашних условиях
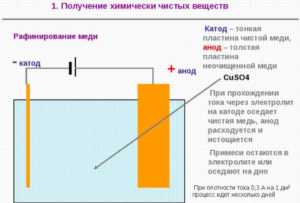
Для омеднения детали необходимо поместить ее в стеклянную емкость с водным электролитом, состоящим из медного купороса и серной кислоты. Предмет подвешивается на проводе таким образом, чтобы он не касался стенок и дна емкости. По обе стороны от заготовки размещаются медные пластины, являющиеся электродами. После этого к электродам и заготовке подключается источник постоянного тока. Степень омеднения прямо зависит от времени проведения процесса.
Способы нанесения никелевого покрытия
Никелирование изделия в домашних условиях можно выполнить двумя способами: химическим и электролитическим.
Электролитический метод
Нанесение покрытия с использованием электролита называется гальваническим никелированием. Сначала потребуется подготовить водный раствор (электролит). Для этого необходимы следующие компоненты:
- сернокислый никель – 70 г;
- сернокислый магний – 15 г;
- поваренная соль – 2.5 г;
- сернокислый натрий – 25 г;
- борная кислота – 10г;
- вода – 500г.
Каждый из компонентов нужно отдельно растворить в воде и профильтровать. Полученные растворы смешивают и заливают в стеклянную емкость. Для гальванического никелирования в сосуд с электролитом помещают никелевые электроды. Чтобы покрытие на заготовке было равномерным, со всех сторон устанавливают не менее двух электродов.
Подготовленную заготовку помещают в сосуд между электродами таким образом, чтобы она не касалась стен и дна емкости. Электроды соединяют между собой медными проводниками, и подключают к плюсовому контакту источника постоянного тока. Токопроводящий провод подключают к минусовому выводу.
Схема установки для электролитического никелирования
В процессе никелирования стали напряжение питания не должно превышать 6 Вольт. Следует контролировать плотность тока, она не должна превышать 1,2 А. Процесс занимает около 30–40 минут. По его окончании, предмет нужно промыть проточной водой и тщательно просушить. Нанесенное покрытие должно получиться матовым и гладким. Чтобы поверхность изделия приобрела блеск, потребуется выполнить ее полировку.
Химический метод
Никелирование стали и других металлов химическим способом отличается от гальванического прочностью покрытия. При помощи химического никелирования можно легко нанести вещество даже на самые труднодоступные места.
Для выполнения процесса потребуется:
- янтарно-кислый натрий – 7.5 г;
- хлористый никель – 12.5 г;
- гипофосфит натрия – 15 г;
- вода – 500 мл.
В эмалированную посуду наливают воду и растворяют в ней янтарно-кислый натрий и хлористый никель. Затем раствор нагревают до температуры 90 градусов. По достижению требуемой температуры добавляется гипофосфит натрия. Изделие аккуратно подвешивается над емкостью с раствором. Количество жидкости рассчитывается исходя из того, что в 1 литре раствора можно покрыть поверхность площадью 2дм2.
Никелирование контролируется визуально: когда деталь равномерно покроется пленкой, процесс завершается. По окончании, деталь нужно промыть в растворе, изготовленном из воды и небольшого количества мела. После этого осуществляют сушку и полировку детали.

Как увеличить срок службы покрытия?
Полученное покрытие имеет пористую структуру. Поэтому металл изделия подвержен коррозии. Чтобы снизить риск ее возникновения, слой никеля покрывают смазочными составами. После их нанесения предмет погружают в емкость с рыбьим жиром. Спустя 24 часа, его излишки убирают при помощи растворителя.
Если изделие имеет крупные габариты, и погрузить его в емкость невозможно, то его поверхность просто натирают рыбьим жиром. Данную процедуру потребуется проводить дважды, с промежутком времени около 12 часов. Через 48 часов после обработки остатки жира нужно удалить.
Никелирование защищает металл от коррозии
Выполнить никелирование стали в домашних условиях можно двумя способами. Данный процесс является несложным, но требует тщательной подготовки и предельной аккуратности при выполнении. Необходимо приобрести качественные компоненты для приготовления раствора, заранее подготовить рабочую зону, емкости, инструменты и устройства.
В процессе работы важно соблюдать меры безопасности: защитить глаза и кожные покровы от попадания химических веществ, обеспечить достаточную вентиляцию помещения, предотвратить возможность воспламенения смеси и электрической установки.
Видео по теме: Химическая металлизация — никелирование
vtorexpo.ru
Химическое никелирование деталей – всё о процессе и особенностях + Видео
Никелирование химическое — это сложный процесс, позволяющий покрыть изделия из практически любого металла тонким защитным слоем никеля, повысить при этом коррозионную стойкость и придать поверхности блестящий вид и твердость.
1 Процесс химического никелирования деталей
Свойство никеля создавать на своей поверхности тонкую оксидную пленку, устойчивую к действию кислот и щелочей, позволяет использовать его для антикоррозионной защиты металлов.
Основной метод, применяющийся в промышленности — гальваническое никелирование, но оно требует наличия достаточно сложного оборудования и подразумевает работу с кислотами и щелочами, пары которых выделяются во время работы и могут сильно навредить здоровью человека. Для покрытия стали, алюминия, латуни, бронзы и других металлов может быть применен химический способ, так как он прост в использовании, и этот процесс можно проводить в домашних условиях.
На сегодняшний день существует два основных метода покрытия металлических деталей никелем: гальваническое и химическое. Первый метод требует наличия источника постоянного тока — электролитической ванны с электродами и большого количества химических реактивов. Второй способ намного проще. Для его проведения требуется наличие мерной посуды и эмалированной емкости для нагрева реактивов. Несмотря на всю кажущуюся простоту, это довольно сложный процесс, который требует большого внимания и соблюдения правил безопасности. По возможности проводите реакции в хорошо проветриваемом помещении. Идеальным вариантом будет оборудование рабочего места вытяжкой, ни в коем случае не соединенной с общедомовой вентиляцией. При работе пользуйтесь защитными очками, не оставляйте емкость с реактивами без присмотра.

Покрытие металлических деталей никелем
Рекомендуем ознакомиться
Основные стадии для произведения химического никелирования следующие:
- Для того чтобы никель покрыл поверхность тонким и равномерным слоем, изделие предварительно шлифуют и полируют.
- Обезжиривание. Поскольку даже тончайшая пленка жира на поверхности обрабатываемого изделия может вызвать неравномерное распределение никеля по площади детали, последнюю обезжиривают в специальном растворе, состоящем из 25-35 г/л NaOH или KOH, 30-60 г кальцинированной соды и 5-10 г жидкого стекла.
- Деталь или изделие, которое необходимо покрыть никелем, промывают в воде, после чего на 0,5-1 минуту погружают в 5% раствор HCl. Данный шаг предпринимается для того, чтобы удалить с поверхности металла тонкий слой окислов, который будет значительно снижать адгезию между материалами. После протравки деталь снова промывают в воде, затем немедленно переносят в емкость с раствором для покрытия никелем.
Собственно никелирование производят при помощи кипячения металлического изделия в специальном растворе, который готовят следующим образом:
- берут воду (желательно — дистиллированную) из расчета 300 мл/дм2 площади поверхности детали, включая как внутреннюю, так и внешнюю;
- воду нагревают до 60°С, после чего растворяют в ней 30 г хлористого никеля (NiCl2) и 10 г уксуснокислого натрия (CH3COONa) на 1 л воды;
- температуру поднимают до 80°С и добавляют 15 г гипосульфита натрия, затем в емкость с раствором погружают обрабатываемую деталь.
Кипячение металлического изделия
После погружения детали, раствор нагревают до 90-95°С и поддерживают температуру на таком уровне в течение всего процесса никелирования. Если вы увидели, что количество раствора сильно уменьшилось, можно добавить в него предварительно нагретую дистиллированную воду. Кипячение должно проходить не менее 1-2 часов. Иногда для получения многослойного покрытия, изделия из металла подвергают серии коротких (20-30 минут) кипячений, после каждого из которых деталь достают из раствора, промывают и высушивают. Это дает возможность получить слой никеля из 3-4 прослоев, которые суммарно имеют большую плотность и качество, чем одинарный слой той же мощности.
Особенность покрытия стальных изделий в том, что никель осаждается самопроизвольно вследствие каталитического воздействия железа. Для осаждения защитного слоя на цветных металлах используется другой состав.
2 Никелирование цветных металлов и сплавов
Химическое никелирование цветных металлов позволяет создавать защитную пленку на поверхности латуни, меди и бронзы. Для этого деталь сначала обезжиривают раствором, состав которого указан в первом способе, причем снимать оксидную пленку с металла не обязательно. Раствор для никелирования готовят следующим образом: в эмалированную емкость наливают 10% раствор хлористого цинка (ZnCl2), который более известен под названием «паяльная кислота». К нему понемногу добавляют сернокислый никель (NiSO4) до такой концентрации, при которой раствор окрашивается в зеленый цвет. Состав доводят до кипения, после чего погружают деталь в него на 1,5-2 часа. После того как реакция закончится, изделие достают из раствора и помещают в емкость с меловой водой (готовится способом добавления 50-70 г мела в порошке на 1 литр воды), а затем промывается.

Раствор сернокислого никеля
Никелирование алюминия проходит по схожей технологии, но состав раствора немного другой:
- 20 г сернокислого никеля;
- 10 г натрия уксуснокислого;
- 25 г натрия фосфорноватистокислого;
- 3 мл тиомочевины концентрацией 1 г/л;
- 0,4 г фтористого натрия;
- 9 мл уксусной кислоты.

Обработка деталей из алюминия
Перед обработкой изделия из алюминия погружают в раствор каустической соды, концентрацией 10-15%, и нагретом до температуры 60-70°С. При этом происходит бурная реакция с выделением водорода, пузырьки которого очищают поверхность от окислов и загрязнения. В зависимости от степени загрязненности, детали выдерживают в очищающем растворе от 15-20 секунд до 1-2 минут, после чего промывают в проточной воде и погружают в никелирующий раствор.
3 Применение никелированных изделий
Вследствие никелирования значительно повышаются физико-механические и декоративные свойства металлических изделий. Никель имеет серебристо-белый цвет, на воздухе быстро покрывается незаметной человеческому глазу пленкой окислов, которые практически не меняют его внешнего вида, но при этом надежно защищают от дальнейшего окисления и реакций с агрессивной средой. Никелирование используется для защиты сталей, бронзы, латуни, алюминия, меди и других материалов.

Защита металлических изделий от окисления
Является катодной защитой. Это значит, что при повреждении целостности покрытия, металл начинает реагировать с внешней средой. Для повышения механических свойств защитного слоя, нужно наносить его, точно придерживаясь технологии и последовательности действий. Никель, нанесенный на поверхность со следами загрязнения и ржавчины, с большим количеством неровностей, может начать вспучиваться и отслаиваться в процессе эксплуатации.
Изделия, покрытые никелем, почти ни в чем не уступают хромированным — имеют похожий блеск и твердость. При больших размерах емкостей для химической реакции никелем можно покрывать довольно большие детали, например, автомобильные диски.
4 Основные выводы по теме
Никелирование придает металлу красивый блестящий вид, высокую коррозионную стойкость и повышает твердость поверхности. Детали, покрытые никелем, можно использовать для украшения столбов ограды, если такую предусматривает проект участка. Красиво выглядят и имеют длительный срок эксплуатации различные метизы — крепежные болты, скобы, элементы мебельной фурнитуры. Они могут быть использованы в условиях повышенной влажности, температуры и нагрузки — в местах, где сталь быстро ржавеет и теряет свойства.
Химическое никелирование можно произвести собственноручно, в условиях хорошо проветриваемого гаража или мастерской.

Красивый блестящий вид поверхности
Нежелательно делать описанные технологические операции на кухне, так как испарения любых химических веществ могут быть опасными для здоровья.
Покрытие никелем с помощью химических реактивов не требует высоких энергозатрат, в отличие от гальванического, но позволяет получить достаточно качественное, блестящее и твердое покрытие.
tutmet.ru
Никелирование в домашних условиях: химическое и электролитическое
В процессе эксплуатации материалы подвержены физическому износу. Для восстановления свойств металла используют многочисленные способы защиты. Одним из самых эффективных методов защиты является никелирование материалов.
Для нанесения никеля в домашних условиях используют способы химического и электролитического никелирования.
Что называют никелированием
Никелированием называют процесс нанесения тонкого никелевого покрытия на поверхность материала. Никелевый слой принимают равным 1–50 мкм.
Слой никеля используется для повышения антикоррозийных и износостойких свойств материалов. Довольно часто такое покрытие имеет защитно-декоративное значение.
Никелирование используется для обработки стали и сплавов цветных металлов. Тонкий слой никеля используется для защиты изделий из марганца, титана, вольфрама, молибдена и сплавов на их основе.
Разработаны и успешно внедрены способы нанесения никелевого защитного покрытия на керамику, пластик, фарфор, стекло и другие неметаллические поверхности.
Виды никелирования
Никелирование в простых домашних условиях проводят двумя способами:
- электролитическим;
- химическим.
Выбор способа зависит от структуры и формы материала.
Электролитическое никелирование
При электролитическом способе используются вещества, частично или полностью состоящие из ионов и обладающие ионной проводимостью. Никелевое покрытие наносят за счет электрохимических свойств этих веществ. Наибольшее распространение получили электролиты сернокислого натрия и хрома.
В зависимости от степени отражения покрытия различают никелирование:

Функции электролитического никелирования
- матовое;
- блестящее.
Для нанесения матового покрытия используются электролиты без добавок. Изделия с матовым оттенком не имеют металлического блеска.
Блестящее никелирование получают путем добавления в электролит специальных блескообразователей на основе хлорамина, пропаргилового спирта, бепзосульфамида и других окислителей.
Наилучшая защита никелевого покрытия достигается при минимальной пористости защитного слоя. С этой целью производят его омеднение либо используют многослойную структуру материала.
К сведению. При одинаковой толщине многослойные покрытия в несколько раз надёжнее однослойных материалов.
Наиболее распространёнными примерами многослойных материалов являются медно-никелево-хромовые покрытия.
Основными недостатками электролитического никелирования являются:
- высокая степень пористости;
- неравномерность осаждения никеля;
- сложность обработки поверхностей со сложной формой.
Химическое никелирование
Основой метода служит свойство ионов никеля восстанавливаться в жидкой среде. С этой целью используют гипофосфит натрия или другие химические реактивы. Химический способ позволяет обрабатывать изделия со сложной формой поверхности.
Недостатком способа является относительная дороговизна сухих реактивов, используемых для приготовления водных химических растворов.

Проведение электролитического никелирования дома
Электролитическое (гальваническое) никелирование деталей проводят двумя способами:
- погружением деталей в электролит;
- без погружения деталей в электролит.
Первый способ используют при обработке небольших по размеру деталей. Второй способ используют при обработке больших и тяжелых предметов.
Перед никелированием выполняют процесс омеднения металла.

Омеднения металла имеет общее определение такое как — гальваностегия
Метод с погружением в электролит

Основные этапы процесса
По первому способу поверхность изделия шлифуют наждачной бумагой для снятия оксидной пленки. Затем образец промывают в теплой воде. После этого его обрабатывают содовым раствором и вновь промывают в теплой чистой воде.
Затем в стеклянную или фарфоровую посуду помещают две тонкие медные пластины. Пластины играют роль анодов. Их ставят в вертикальном положении, параллельно друг другу.
Изделие помещают между этими двумя пластинами. Для этого образец подвешивают с помощью проволоки. Проволоку обоими концами прикрепляют к пластинам.
В посуду добавляют водный раствор электролита со следующим составом:
- дистиллированная вода;
- 20%-ный медный купорос;
- 2%-ная серная кислота.
Медные пластины подключают к источнику электроснабжения. Величину напряжения определяют из расчета 15–20 мА на 1 см2 поверхности материала.
К сведению. Никелевый электролит чувствителен к изменениям кислотности. Для поддержания уровня кислотности используют буферные соединения на основе борной кислоты.
 В растворе электролита хлорид меди диссоциирует (распадается) на составляющие компоненты. Ионы меди смещаются к катоду и превращаются в нейтральные атомы. Ионы хлора окисляются у анода.
В растворе электролита хлорид меди диссоциирует (распадается) на составляющие компоненты. Ионы меди смещаются к катоду и превращаются в нейтральные атомы. Ионы хлора окисляются у анода.
При пропускании тока через электролит ионы меди переходят в раствор. Из раствора медь оседает на катоде в виде нейтральных атомов. Примеси остаются на дне посуды. Чистота полученной меди составляет почти 100%.
Через 30 минут на детали образуется тонкий слой меди. Воздействие электрического тока вызывает увеличение толщины медного слоя. Чем больше толщина слоя, тем меньшее количество пор остается на обрабатываемой поверхности.
Метод без погружения деталей в электролит
Гальваническое никелирование
Гальваническое никелирование больших по размеру деталей производят без погружения их в электролит. Для этого используют кисточку из распущенных медных проволок. В качестве кисточки часто используют очищенный от изоляции многожильный медный кабель.
Увеличением напыляемого медного слоя добиваются устранения пористости поверхности образца.
Процесс осаждения никеля проводят аналогично процессу омеднения поверхности. Для этого в емкость добавляют электролит. В состав электролита входят следующие химические реагенты, г/л:
- раствор сернокислого натрия – 310;
- раствор хлористого никеля – 65;
- ортоборная кислота – 45;
- 1,4-бутандиол – 0,15;
- орто-сульфобензимид (сахарин) – 2,0;
- каолин (известь) – 1,0.
 В электролит опускают тонкие никелевые пластины. Они играют роль анодов. Между ними помещают изделие. Концы пластин подключают к клемме источника питания с положительным зарядом. Корпус детали присоединяют к отрицательному полюсу.
В электролит опускают тонкие никелевые пластины. Они играют роль анодов. Между ними помещают изделие. Концы пластин подключают к клемме источника питания с положительным зарядом. Корпус детали присоединяют к отрицательному полюсу.
Для регулирования величины тока используют реостат. Контроль величины подаваемого электрического тока проводят с помощью миллиамперметра. Величина подаваемого тока не должна превышать 6 В. Осаждение никеля проводят при температуре около 50°С и плотности электротока 4–5 А/ дм2. Продолжительность процесса – 3 мин.
К сведению. Никелевое покрытие без подложки имеет довольно слабое сцепление с поверхностью. С целью повышения адгезии используют термическую обработку изделия при температуре 450 градусов.
Завершающий этап обработки детали
Обработанную деталь промывают под потоком чистой теплой воды и подвергают сушке.
Никелированное покрытие обладает матовым оттенком. Для придания блеска деталь полируют.
Никелевые покрытия с дефектами удаляют с помощью анодного растворения в электролите. Для этого в состав электролита включают серную кислоту. Химическую плотность кислоты принимают равной 1,2-2,8 кг/м3. Процесс снятия слоя никеля проводят при температуре 20-25° С и анодной плотности электротока 5 А/дм2.

Проведение химического никелирования дома
Химический способ никелирования в домашних условиях проводят с помощью рабочих растворов. В зависимости от количества сухих реагентов, скорость увеличения никелевого слоя составляет 80 мкм/ч и более.
В состав рабочего раствора входят следующие реагенты, г/л:
Физические способы нанесения металлических покрытий
- никелевый купорос (порошок сернокислого никеля) – 20;
- галенит (порошок сульфида свинца) – 20;
- ацетат натрия – 15;
- раствор гипофосфита натрия – 25.
Рабочая температура химического раствора– 90°С. При удалении свинцового реагента скорость реакции снижается до 50 мкм/ч и менее.
При достижении рабочей температуры, в емкость с раствором опускают обрабатываемую деталь. Перед проведением никелирования покрытие очищают и обезжиривают.
Изделие выдерживают в рабочем растворе на протяжении 1 часа. По мере испарения добавляют дистиллированную воду.
По завершении процесса деталь вынимают и промывают в теплой воде. После ополаскивания изделие подвергают тщательной сушке. При необходимости тщательно полируют.

Химические процессы противокоррозионной защиты деталей
Увеличение срока службы никелевого покрытия
Никелевое покрытие может быть подвержено сплошной поверхностной коррозии. Процесс коррозии проявляется только в начальный период. По мере увеличения температуры рабочего раствора, поверхностная коррозия проникает вглубь материала. Затем этот процесс замедляется и полностью прекращается.

Омеднение ключа
Для увеличения срока службы никелевого покрытия используют технологию омеднения. Омеднение позволяет устранить и незначительные дефекты поверхности. Нанесение меди в качестве подложки обеспечивает надежность и долговечность никелевой защиты.
Пористость медного покрытия вызывает разрушение защитного слоя и уменьшает срок службы готового изделия. Металл подложки подвергается коррозии с последующим отслаиванием защитного слоя.
Чаще всего процессам коррозии подвергаются изделия с однослойным защитным покрытием. Многослойные детали подвергаются воздействию вредных факторов в меньшей степени.
Для защиты изделий от повреждения проводят ряд дополнительных мероприятий. Используют специальные добавки, которыми закрывают поры.
К сведению. Для предотвращения потери твердости никелирование стали проводят при температуре 250-300ºС.
Дополнительная обработка деталей для продления срока службы
Никелирование на дому проводят с использованием следующих способов:
- Сухой реактив оксида магния смешивают с водой до кашеобразного состояния. Полученной массой тщательно обрабатывают деталь и погружают ее на несколько минут в 50%-ную соляную либо серную кислоту.
- Рабочую поверхность протирают проникающей смазкой. Затем изделие погружают в очищенный рыбий жир. Излишки жира через сутки удаляют с помощью бензина или других растворителей.
- Большие по размеру детали обрабатывают рыбьим жиром за два прохода. Промежуток между обработками должен составлять не менее 12 часов. Через два дня излишки рабьего жира удаляют.

Схема установки для никелирования в домашних условиях
Использование сплавов никеля с другими металлами способно улучшить физико-химические свойства никеля.
Алюминий способствует повышению электрического сопротивления и коррозионной стойкости никеля.
Вольфрам, молибден и титан увеличивают его термостойкость.
Добавление хрома приводит к повышению стойкости никелевого покрытия в окислительных и восстановительных растворах.
Медь увеличивает сопротивляемость никеля действию различных кислот.
Видео по теме: Средство для никелирования
promzn.ru
Никелирование в домашних условиях своими руками: технология, советы
Никелирование, которое является достаточно распространенной технологической операцией, выполняют для того, чтобы нанести на поверхность металлического изделия тонкий слой никеля. Толщина такого слоя, величину которого можно регулировать, используя различные приемы, может варьироваться от 0,8 до 55 мкм.

Никелирование используется в качестве защитно-декоративного покрытия, а также для получения подслоя при хромировании
С помощью никелирования металла можно сформировать пленку, обеспечивающую надежную защиту от таких негативных явлений, как окисление, развитие коррозионных процессов, реакции, вызванные взаимодействием с соляной, щелочной и кислотной средами. В частности, очень большое распространение получили никелированные трубы, которые активно используются для производства изделий сантехнического назначения.
Чаще всего никелированию подвергаются:
- изделия из металла, которые будут эксплуатироваться на открытом воздухе;
- кузовные детали мото- и автотранспортных средств, в том числе и те, для изготовления которых был использован алюминиевый сплав;
- оборудование и инструменты, применяемые в общей медицине и стоматологии;
- изделия из металла, которые длительное время эксплуатируются в воде;
- ограждающие конструкции, изготовленные из стали или алюминиевых сплавов;
- изделия из металла, подвергающиеся воздействию сильных химических веществ.
Существует несколько используемых как в производственных, так и в домашних условиях методов никелирования металлических изделий. Наибольший интерес в практическом плане представляют способы никелирования металлических деталей, не требующие применения сложного технологического оборудования и реализуемые в домашних условиях. К таким способам относится электролитическое и химическое никелирование.
Свойства гальванического и химического покрытия никелем
Электролитическое никелирование
Суть технологии электролитического никелирования металлических деталей, имеющей и другое название – «гальваническое никелирование», можно рассмотреть на примере того, как выполняется омеднение поверхности изделия из металла. Такую процедуру можно проводить как с применением электролитического раствора, так и без него.
Деталь, которая будет в дальнейшем обрабатываться в электролитическом растворе, подвергается тщательной обработке, для чего с ее поверхности при помощи наждачной бумаги удаляют оксидную пленку. Затем обрабатываемое изделие промывается в теплой воде и обрабатывается содовым раствором, после чего снова промывается водой.

Крупные детали лучше очищать пескоструйным аппаратом
Сам процесс никелирования выполняется в стеклянной емкости, в которую заливается водный раствор (электролит). В составе такого раствора содержится 20% медного купороса и 2% серной кислоты. Обрабатываемую деталь, на поверхность которой необходимо нанести тонкий слой меди, в растворе электролита помещают между двумя анодами из меди. Чтобы запустить процесс омеднения, на медные аноды и обрабатываемую деталь необходимо подать электрический ток, величину которого рассчитывают, исходя из показателя 10–15 мА на один квадратный сантиметр площади детали. Тонкий слой меди на поверхности изделия появляется уже через полчаса его нахождения в растворе электролита, причем такой слой будет тем толще, чем дольше будет протекать процесс.

Схема установки для электролитического никелирования
Нанести медный слой на поверхность изделия можно и по другой технологии. Для этого необходимо изготовить кисточку из меди (можно использовать многожильный провод, предварительно сняв с него изоляционный слой). Такую кисточку, сделанную своими руками, надо зафиксировать на деревянной палочке, которая будет служить ручкой.
Изделие, поверхность которого предварительно зачищают и обезжиривают, помещают в емкость из диэлектрического материала и заливают электролитом, в качестве которого можно использовать насыщенный водный раствор медного купороса. Самодельную кисточку подключают к плюсовому контакту источника электрического тока, а обрабатываемую деталь – к его минусу. После этого приступают к процедуре омеднения. Заключается она в том, что кисточкой, которую предварительно обмакивают в электролит, проводят над поверхностью изделия, не прикасаясь к ней. Наносить покрытие, применяя такую методику, можно в несколько слоев, что позволит сформировать на поверхности изделия слой меди, на котором практически отсутствуют поры.
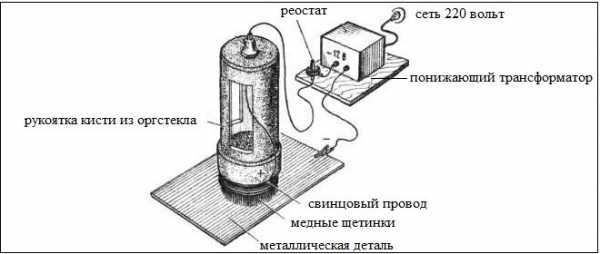
Схема простого приспособления для нанесения покрытия
Электролитическое никелирование выполняется по схожей технологии: при его осуществлении тоже используется раствор электролита. Так же, как и в случае с омеднением, обрабатываемое изделие располагают между двумя анодами, только в данном случае они изготовлены из никеля. Аноды, помещенные в раствор для никелирования, подключаются к плюсовому контакту источника тока, а изделие, подвешенное между ними на металлической проволоке, – к минусовому.
Для осуществления никелирования, в том числе и выполняемого своими руками, используются электролитические растворы двух основных типов:
- водный раствор, включающий в свой состав сернокислый никель, натрий и магний (14:5:3), 2% борной кислоты, 0,5% поваренной соли;
- раствор на основе нейтральной воды, содержащий в своем составе 30% сульфата никеля, 4% хлорида никеля, 3% борной кислоты.

Электролит блестящего никелирования с добавкой органических блескообразователей (натриевых солей)

Выравнивающий электролит блестящего никелирования. Подходит для поверхностей с низким классом очистки
Чтобы приготовить электролитический раствор, сухую смесь из вышеуказанных элементов заливают одним литром нейтральной воды и тщательно перемешивают. Если в полученном растворе образовался осадок, от него избавляются. Только после этого раствор можно использовать для выполнения никелирования.
Обработка по данной технологии обычно длится полчаса, при этом используют источник тока с напряжением 5,8–6 В. Результатом является поверхность, покрытая неравномерным матовым цветом серого цвета. Чтобы она стала красивой и блестящей, необходимо ее зачистить и выполнить ее полировку. Следует иметь в виду, что такая технология не может быть использована для деталей, отличающихся высокой шероховатостью поверхности или имеющих узкие и глубокие отверстия. В таких случаях покрытие поверхности металлического изделия слоем никеля следует выполнять по химической технологии, которую также называют чернением.
Электролит для осаждения черного никеля
Суть технологической операции чернения заключается в том, что на поверхность изделия сначала наносится промежуточное покрытие, основой которого может быть цинк или никель, а на верхней части такого покрытия формируется слой черного никеля толщиной не более 2 мкм. Покрытие никелем, выполненное по технологии чернения, смотрится очень красиво и обеспечивает надежную защиту металла от негативного воздействия различных факторов внешней среды.
В отдельных случаях металлическое изделие одновременно подвергают сразу двум технологическим операциям, таким как никелирование и хромирование.
Химическое никелирование
Процедуру химического никелирования изделий из металла выполняют по следующей схеме: обрабатываемую деталь на некоторое время погружают в кипящий раствор, в результате чего на ее поверхности оседают частички никеля. При применении такой технологии электрохимическое воздействие на металл, из которого изготовлена деталь, отсутствует.
Результатом использования такой технологии никелирования является формирование на поверхности обрабатываемой детали никелевого слоя, который прочно связан с основным металлом. Наибольшей эффективности такой способ никелирования позволяет добиться в тех случаях, когда с его помощью обрабатываются предметы, изготовленные из стальных сплавов.
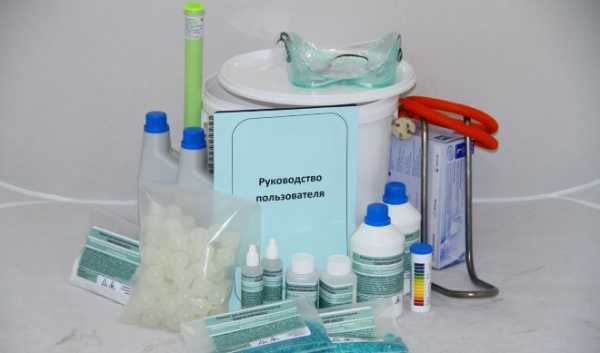
Комплект для нанесения никелированного покрытия химическим способом
Выполнять такое никелирование в домашних условиях или даже в условиях гаража нетрудно. При этом процедура никелирования проходит в несколько этапов.
- Сухие реактивы, из которых будет приготовлен электролитический раствор, смешиваются с водой в эмалированной посуде.
- Полученный раствор доводят до кипения, а затем в него добавляют гипофосфит натрия.
- Изделие, которое необходимо подвергнуть обработке, помещают в электролитический раствор, причем делают это так, чтобы оно не касалось боковых стенок и дна емкости. Фактически надо изготовить бытовой аппарат для никелирования, конструкция которого будет состоять из эмалированной емкости соответствующего объема, а также диэлектрического кронштейна, на котором будет фиксироваться обрабатываемая деталь.
- Продолжительность кипения электролитического раствора в зависимости от его химического состава может составлять от одного часа до трех.
- После завершения технологической операции уже никелированная деталь извлекается из раствора. Затем ее промывают в воде, в составе которой содержится гашеная известь. После тщательной промывки поверхность изделия подвергается полированию.

Процесс никелировки в домашних условиях
Электролитические растворы для выполнения никелирования, которому можно подвергать не только сталь, но также латунь, алюминий и другие металлы, обязательно содержат в своем химическом составе следующие элементы – хлористый или сернокислый никель, гипофосфит натрия различной кислотности, какую-либо из кислот.
Чтобы увеличить скорость никелирования изделий из металла, в состав для выполнения этой технологической операции добавляют свинец. Как правило, в одном литре электролитического раствора выполняют никелевое покрытие поверхности, площадь которой составляет 20 см2. В электролитических растворах с более высокой кислотностью проводят никелирование изделий из черных металлов, а в щелочных обрабатывают латунь, осуществляют никелирование алюминия или деталей из нержавеющей стали.
Некоторые нюансы технологии
Выполняя никелирование латуни, изделий из стали различных марок и других металлов, следует учитывать некоторые нюансы этой технологической операции.
- Пленка из никеля будет более устойчивой, если она нанесена на предварительно омедненную поверхность. Еще более устойчивой никелированная поверхность будет в том случае, если готовое изделие будет подвергнуто термической обработке, заключающейся в его выдержке при температуре, превышающей 450°.
- Если никелированию подвергаются детали из закаленных сталей, то нагревать и выдерживать их можно при температуре, не превышающей 250–300°, иначе они могут утратить свою твердость.
- При никелировании изделий, отличающихся большими размерами, возникает потребность в постоянном перемешивании и в регулярной фильтрации электролитического раствора. Такая сложность особенно характерна для процессов никелирования, выполняемых не в промышленных, а в домашних условиях.

Причины дефектов никелирования
По сходной с никелированием технологии можно покрыть латунь, сталь и другие металлы слоем серебра. Покрытие из данного металла наносят, в частности, на рыболовные снасти и изделия другого назначения, чтобы предотвратить их потускнение.
Процедура нанесения слоя серебра на сталь, латунь и другие металлы отличается от традиционного никелирования не только температурой проведения и временем выдержки, но также тем, что для нее применяют электролитический раствор определенного состава. При этом выполняют данную операцию в растворе, температура которого составляет 90°.

Никелированные латунные фитинги
Чтобы своими руками приготовить раствор, при помощи которого на сталь, латунь и другие металлы наносится слой серебра, достаточно выполнить ряд несложных действий.
- В 10%-й водный раствор соли добавляют аптечный ляпис.
- Осадок серебра, выпавший в растворе, промывают, смешивают с 2%-м гипосульфитом и фильтруют.
- Полученную смесь смешивают с меловой пылью и доводят до сметанообразного состояния.
Такой смесью, которая может храниться только в течение нескольких суток, натирается поверхность металлического изделия, пока на ней не сформируется тонкий слой серебра.

Полученное покрытие легко полируется до блеска
Можно приготовить порошок для серебрения, который не утратит своих характеристик в течение полугода. Для получения такого порошка необходимо смешать 15 граммов ляписа, 55 граммов лимонной кислоты и 30 граммов хлористого аммония. Все компоненты после перемешивания следует перетереть в пыль. Хранится полученный порошок в сухом виде.
Достаточно сложным является никелирование такого металла, как алюминий. Компоненты, входящие в состав электролитического раствора для никелирования изделий из данного металла, дорогостоящие, но даже их использование не дает гарантии того, что сформированный на изделии слой никеля не пойдет пузырями. Блестящее никелирование, если ему подвергают алюминий, может порвать готовое покрытие, поэтому в домашних условиях такую обработку выполняют в условиях слабой адгезии.
Оценка статьи:
Загрузка…Поделиться с друзьями:
met-all.org
Химическое никелирование диэлектриков
Химическое никелирование диэлектриков
Чтобы покрыть диэлектрик слоем химического никеля, его нужно сначала активировать в палладиевом активаторе, затем погрузить в раствор химического никелирования. Как сделать такой раствор никелирования, пойдет речь в данной статье.
Приготовление раствора химического никелирования
Рецепт раствора химического никелирования на 1 литр:
Хлорид никеля — 15 гр.
Ацетат натрия — 10 гр.
Хлорид аммония — 50 гр.
Гипофосфит натрия — 30 гр.
Тиомочевина — 0,002 гр.
Вода — до 1 литра
Приступим к приготовлению. Наливаем в емкость примерно 900 мл дистиллированной воды, взвешиваем 15 грамм хлорида никеля, растворяем его в воде. Затем взвешиваем 10 грамм ацетата натрия (как сделать ацетат натрия самому, написано в этой статье), высыпаем его в емкость с хлоридом никеля и растворяем. Затем взвешиваем 50 грамм хлорида аммония и растворяем там же.
После растворения доводим объем раствора водой до 1 литра. Переливаем в емкость для хранения и подписываем, это будет раствор номер один.
Далее взвешиваем 30 грамм гипофосфита натрия и растворяем его в 100 мл дистиллированной воды. Чтобы взвесить 0.002 грамм тиомочевины, поступаем так. Наливаем в емкость 1 литр воды, взвешиваем 1 грамм тиомочевины и растворяем ее в этом литре воды.
1 мл этого раствора будет равен 0,001 грамму тиомочевины.
Переливаем раствор тиомочевины в малую емкость, подписываем ее, остальное выливаем (можете не выливать, на ваше усмотрение).
Как писал выше, 1 мл этого раствора равен 0,001 грамм тиомочевины, нам по рецепту нужно 0,002 грамма. Берем 2 мл этого раствора, что соответствует 0,002 грамма тиомочевины и добавляем его к раствору гипофосфита натрия.
Переливаем этот гипофосфитный раствор в отдельную емкость, подписываем. Это будет раствор номер два. В итоге получили два раствора для химического никелирования.
Почему было сделано два раствора? Время жизни раствора химического никелирования, после добавления в него гипофосфита натрия, небольшое. Поэтому состав раствора был разделен на две части, чтобы попросту не переводить реактивы.
Как пользоваться данным раствором никелирования? Наливаем в емкость например 100 мл первого раствора и 10 мл второго раствора, хорошо перемешиваем, нагреваем до температуры 50..90 градусов и используем.
Если во время использования раствора никелирования, наблюдается самопроизвольное газовыделение (в пустой емкости, без покрываемой детали), то это значит, что раствор загрязнился и его срочно нужно профильтровать.
Также, если будет замечено что в чистом растворе идет бурная реакция газообразования (саморазряд раствора никелирования), то возможно добавлено мало тиомочевины. Советую к раствору номер два (к гипофосфиту), добавить еще 1 мл раствора тиомочевины.
Следует понимать, что тиомочевина является стабилизатором раствора и если вы ее положите больше чем надо, то раствор химического никелирования попросту не будет работать (деталь не будет покрываться никелем), учтите это.
Как хранить раствор никелирования? После добавления гипофосфита натрия в раствор никелирования, время жизни его ограничено и варьируется от 1 дня до 1 месяца. Чтобы как можно дольше сохранить работающий раствор, его после применения нужно профильтровать, плотно закрыть и поставить в холодное место (можно даже в холодильник).
Не смешанные, раствор номер один и раствор номер два, могут храниться сколь угодно долго в темном прохладном месте.
И еще хотел добавить, признаком истощенности рабочего раствора, является смена его окраски с зеленого на бесцветный. Такой раствор после использования можно вылить и развести новый.
Подготовка поверхности диэлектрика
Чтобы нанести качественное покрытие на диэлектрик, его нужно подготовить. В этап подготовки входит обезжиривание, подтравливание диэлектрика в специальных растворах для придания микрошероховатости поверхности и промывка в воде.
В данной статье я ограничился обезжириванием и промывкой в воде. Сначала обезжириваем диэлектрик в растворе обезжиривания (как сделать такой раствор, можно посмотреть в этой статье), нагретым до 50..60 градусов.
Затем промываем в воде и опускаем в нагретый до 50 градусов димексид. Потом промываем в воде и видим, что вода не скатывается с поверхности, что означает качественное обезжиривание. Если вода скатывается, то повторяем операцию (обезжириватель, затем димексид).
Если вы проигнорируете этап обезжиривание, то получите некачественное, с проплешинами покрытие. Об этом будет показано чуть ниже.
Тестирование раствора химического никелирования
В данном тесте будут покрыты пластиковая ложка и кусочек текстолита и использован палладиевый совмещенный активатор (как сделать такой активатор можно посмотреть в этой или в этой статье). Оба активатора с высокими активирующими способностями, выбирайте любой, какой проще вам сделать.
Пластиковая ложка
Обезжиренную ложку опускаем в раствор предактиватора на 1 минуту. Затем без промывки в воде, опускаем в активатор на 1..2 минуты.
После активатора, промываем в проточной воде 1..2 минуты и опускаем ложку в раствор ускорения на 2 минуты.
Промываем в проточной воде и опускаем в горячий 50..90 градусов раствор химического никелирования.
Видео процесса химического никелирования
Результат химического никелирования
Получаем вот такую зеркальную ложку, с нанесенным химическим никелем.
Плохое обезжиривание
Как я писал выше, если пренебречь этапом обезжиривания, то в результате получим некачественное покрытие. На фото ниже, видно, что вода собирается в капли на поверхности ложки. Как раз в этих местах, откуда вода скатилась, не будет покрытия никелем. Это хорошо видно на видео.
Видео с результатом плохого обезжиривания
Данная статья опубликована на сайте whoby.ru. Постоянная ссылка на эту статью находится по этому адресу http://whoby.ru/page/himicheskoe-nikelirovanie
Читайте статьи на сайте первоисточнике, не поддерживайте воров.
Нанесение химического никеля на текстолит
Обезжириваем текстолит, промываем в воде, опускаем его в раствор предкативатора на 1 минуту. Затем не промывая в воде, опускаем его в раствор активатора на 1..2 минуты (как сделать такой активатор, я давал ссылки чуть выше).
Промываем текстолит в проточной воде 1..2 минуты и переносим текстолит в ускоритель на 2 минуты.
Промываем текстолит в воде и опускаем его в горячий раствор химического никелирования.
Видео химического никелирования текстолита
В данном видео показан процесс нанесения никеля на текстолит из другого опыта. Прошу не обращать на это внимание. акцентируйте свое внимание на сам процесс активации диэлектрика в совмещенном палладиевом активаторе и на процессе химического никелирования.
Результат нанесения химического никеля на текстолит
Первый опыт
Текстолит покрылся равномерным слоем никеля без проплешин и артефактов. Поверхность слоя не блестящая, а матовая. Такой эффект матовости получается из за того, что сама поверхность текстолита матовая и поэтому осажденный слой никеля тоже матовый.
Если поверхность будет глянцевой (как в случае с ложкой), то и осажденный слой никеля будет тоже глянцевым.
Второй опыт
В этом опыте использовался текстолит от печатной платы с медной фольгой. Фольга имела блеск и поэтому в этих местах, никель осел глянцевым слоем. Где фольги нет, там слой никеля матовый.
На этом процесс нанесения химического никеля с использованием палладиевого совмещенного активатора заканчиваю, переходим дальше.
Можно ли активировать серебром?
Серебряный активатор стоит намного дешевле палладиевого и возникает вопрос, можно ли заменить палладиевый активатор на серебряный? Если активировать диэлектрик серебром и пытаться нанести сразу химический никель, то не получится. А вот если после активации серебром нанести слой химической меди, то на нее можно нанести никель.
Ответ на этот вопрос и да и нет. Напрямую — нет, если использовать промежуточный слой — да.
Этим сейчас и займемся, а именно нанесем слой химической меди и на нее нанесем слой химического никеля.
В тесте (как обычно) будут участвовать пластиковая ложка и текстолит.
Пластик
Обезжириваем пластик, промываем в воде, опускаем в раствор сенсибилизации на 1 минуту. Затем промываем в воде 1..2 минуты.
Опускаем плату в раствор серебряного активатора на 1 минуту (как сделать такой активатор, можно посмотреть в этой статье), промываем в воде и переносим диэлектрик в раствор химического меднения (как сделать раствор химического меднения, можно посмотреть в этой статье).
После химического меднения, поверхность диэлектрика принимает такой вид.
Опускаем покрытый медью диэлектрик в раствор химического никелирования. Касаемся алюминиевым предметом до медной поверхности, для активации поверхности и медь покрывается слоем никеля. После никелирования имеет такой вид.
Видео химического никелирования медной поверхности
Сравнение палладиевый активатор и серебряный
Как видно на фото, покрытие с палладиевым активатором — глянцевое, с серебряным активатором — полуматовое. Как я писал раньше, матовость никелю придает шероховатость подложки, чем она больше, тем больше матовость на получаемом слое никеля.
В данном случае медная поверхность получилась матовая и поэтому наблюдается такой эффект.
Почему слой меди получился матовый, я не знаю. Слой меди должен быть, после химического меднения на глянцевую поверхность тоже блестящим и слой никеля, который осаждаем на медь, тоже глянцевый. Разницы в результате не должно быть.
Возможно у меня раствор химического меднения старый и поэтому получился такой результат. Но это не главное, главное — как имея серебряный активатор, нанести слой никеля на диэлектрик, что и было продемонстрировано. Использовать или не использовать такой метод, решать вам.
Текстолит
Обезжириваем текстолит, промываем в воде, опускаем его в раствор сенсибилизации на 1 минуту, затем промываем в воде 1..2 минуты.
После промывки в воде, опускаем текстолит в раствор серебряного активатора на 1 минуту. Промываем в воде и переносим текстолит в раствор химического меднения.
После химического меднения, опускаем текстолит в горячий раствор химического никелирования, касаемся алюминиевым предметом до медной поверхности и осаждаем слой никеля.
Видео осаждения никеля на медь
Прошу простить за качество видео и неправильно поставленный свет, но думаю видно что происходит на видео.
Результат покрытия текстолита слоем химического никеля
Как видим по фото, получилось равномерное матовое покрытие никелем по всей поверхности текстолита. Заодно покрылся и пластиковый пинцет.
Заключение
В этой статье было рассказано как приготовить раствор для химического никелирования и практически проверено два способа активации диэлектрика, палладием и серебром.
Активация палладием не вызывает каких либо сложностей, но если у вас возникнут трудности с его приобретением, то можно заменить на серебро. В этом случае потребуется еще один раствор, это химическое меднение.
Повторю, какой метод использовать, решать вам. Активация серебром вполне работоспособна и имеет право на жизнь.
На этом я заканчиваю, всем зеркальных никелевых покрытий.
Автор статьи: Admin Whoby.Ru
Еще записи по теме
whoby.ru